题目内容
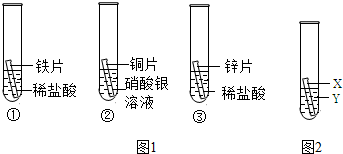 化学小组为探究铁、铜、锌、银的金属活动性顺序,设计如下三个实验(其中金属均已打磨,其形状、大小及同种稀盐酸的用量均相同):
化学小组为探究铁、铜、锌、银的金属活动性顺序,设计如下三个实验(其中金属均已打磨,其形状、大小及同种稀盐酸的用量均相同):(1)一段时间后,观察到实验②的铜片表面有银白色固体附着,这说明铜比银的化学活动性
(2)甲同学认为通过实验①和③可比较锌和铁的金属活动性,他依据的实验现象是
(3)乙同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基础上,利用金属不同的化学性质补充了一个实验(图所示),从而实现了探究目的.乙同学的实验:金属X和溶液Y分别是
考点:金属活动性顺序及其应用
专题:金属与金属材料
分析:要比较金属的活泼性,主要是利用了金属与酸、与盐溶液的反应来得出结论的.通过Zn、Fe都与盐酸反应但快慢不同,Cu能与硝酸银溶液反应置换出Ag,能比较Zn、Fe,Cu、Ag的活动性.但铜与铁的活动性强弱不能证明,因此要加一个实验来证明,可以直接用金属与盐溶液反应,也可通过与酸反应证明.
解答:解:(1)在实验②中,铜能与硝酸银溶液反应生成了银和硝酸铜,反应的化学方程式为:Cu+2AgNO3═Cu(NO3)2+2Ag,这说明铜比银的化学活动性强;
(2)甲同学认为通过实验①和③可比较锌和铁的金属活动性,他依据的实验现象是:锌与稀盐酸反应比铁与稀盐酸反应剧烈些;
(3)通过上述反应,金属的活动性是Zn>Fe,Cu>Ag的活动性.但铜与铁的活动性强弱不能证明,因此要加一个实验来证明,可以直接用金属与盐溶液反应,也可通过与酸反应证明.所以乙同学的实验:金属X和溶液Y分别是铁、硫酸铜或是铜、硫酸亚铁或铜、稀盐酸.
故答案为:(1)强; (2)锌与稀盐酸反应比铁与稀盐酸反应更剧烈;
(3)铁;硫酸铜溶液(或铜;硫酸亚铁溶液或铜;稀盐酸).
(2)甲同学认为通过实验①和③可比较锌和铁的金属活动性,他依据的实验现象是:锌与稀盐酸反应比铁与稀盐酸反应剧烈些;
(3)通过上述反应,金属的活动性是Zn>Fe,Cu>Ag的活动性.但铜与铁的活动性强弱不能证明,因此要加一个实验来证明,可以直接用金属与盐溶液反应,也可通过与酸反应证明.所以乙同学的实验:金属X和溶液Y分别是铁、硫酸铜或是铜、硫酸亚铁或铜、稀盐酸.
故答案为:(1)强; (2)锌与稀盐酸反应比铁与稀盐酸反应更剧烈;
(3)铁;硫酸铜溶液(或铜;硫酸亚铁溶液或铜;稀盐酸).
点评:本题考查了学生的实验设计能力,属于能力提高型习题,且本题具有开放性,学生的思维空间较大.如(3)中X、Y的选择,能培养学生创新设计的能力.开放型习题有助于学生对知识的综合应用;氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来,这是解决这类问题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
H2中混有的CO2,最好的方法是( )
| A、将混合气体通过灼热的CuO |
| B、将混合气体通入澄清的石灰水 |
| C、将混合气体通入水中 |
| D、将混合气体通过红热的木炭层 |


 2012年6月16日18时37分,“神舟九号飞船”在酒泉卫星发射中心,由长征二号F遥九运载火箭成功发射,准确入轨.
2012年6月16日18时37分,“神舟九号飞船”在酒泉卫星发射中心,由长征二号F遥九运载火箭成功发射,准确入轨.