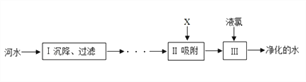
题目内容
【题目】为了达到收旧利废节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:

请回答:(1)操作①中被磁铁吸引的金属A是________;金属B是________。
(2)操作a的名称是_______;在蒸发过程中需要使用玻璃棒,其作用是_____________。
(3)写出步骤②所涉及的化学反应方程式:__________________。
【答案】 铁 铜 过滤 防止滤液局部过热,造成液滴飞溅 Mg+H2SO4=MgSO4+ H2↑
【解析】镁、铁、铜三种金属只有铁能被磁铁吸引,故金属A是铁;在金属活动性顺序中,镁位于氢的前面,铜位于氢的后面,故两种金属中加入稀硫酸,只有镁能与稀硫酸反应生成硫酸镁和氢气,铜不反应,故金属B是铜;硫酸镁溶液经蒸发掉溶剂后,得到的是硫酸镁固体。
(1)铁能被磁铁吸引,故A是铁;在金属活动性顺序中,镁位于氢的前面,铜位于氢的后面,故两种金属中加入稀硫酸,只有镁能与稀硫酸反应生成硫酸镁和氢气,铜不反应,故金属B是铜;(2)通过操作a分别得到了固体和溶液,故是过滤操作;蒸发时要变加热边搅拌,目的是使液体受热均匀,防止滤液局部过热,造成液滴飞溅;(3)镁与稀硫酸反应生成硫酸么和氢气:Mg+H2SO4=MgSO4+ H2↑。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目