题目内容
把6.5g含杂质的锌放入足量稀硫酸中,完全反应后放出0.19g氢气,则锌中可能含有的杂质为(只含有一种杂质)( )A.Mg
B.Al
C.Fe
D.Cu
【答案】分析:根据6.5克的锌全部转化为氢气的质量和6.5克其他金属生成氢气的量采用均衡法进行分析.
解答:解:6.5克锌生成氢气的质量为x,
Zn~~H2
65 2
6.5 x
 =
=
x=0.2g,
A、6.5克镁生成氢气的质量为y
Mg~H2
24 2
6.5 Y
 =
=
Y=0.54g,这两者混合物得到的气体大于0.2g,故A错误;
B、6.5克铝生成氢气的质量为y,
2Al~3H2
54 6
6.5 Y
 =
=
Y=0.72g,这两者混合物得到的气体大于0.2克,故B错误;
C、6.5克铁生成氢气为Z,
Fe---H2
56 2
6.5 Z
 =
=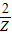
Z=0.23g,这两者混合物得到的气体大于0.2克,故C错误;
D、铜不会与酸反应生成氢气,这两者混合物得到的气体小于0.2克,故D正确;
故选D.
点评:在解此类题时,首先分析各种金属是否会与酸反应,然后根据生成的氢气采用均衡法进行分析.
解答:解:6.5克锌生成氢气的质量为x,
Zn~~H2
65 2
6.5 x
 =
=
x=0.2g,
A、6.5克镁生成氢气的质量为y
Mg~H2
24 2
6.5 Y
 =
=
Y=0.54g,这两者混合物得到的气体大于0.2g,故A错误;
B、6.5克铝生成氢气的质量为y,
2Al~3H2
54 6
6.5 Y
 =
=
Y=0.72g,这两者混合物得到的气体大于0.2克,故B错误;
C、6.5克铁生成氢气为Z,
Fe---H2
56 2
6.5 Z
 =
=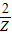
Z=0.23g,这两者混合物得到的气体大于0.2克,故C错误;
D、铜不会与酸反应生成氢气,这两者混合物得到的气体小于0.2克,故D正确;
故选D.
点评:在解此类题时,首先分析各种金属是否会与酸反应,然后根据生成的氢气采用均衡法进行分析.

练习册系列答案
相关题目
把6.5g含杂质的锌放入足量稀硫酸中,完全反应后放出0.19g氢气,则锌中可能含有的杂质为(只含有一种杂质)( )
| A、Mg | B、Al | C、Fe | D、Cu |