题目内容
某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验。
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。
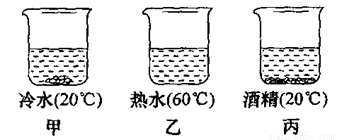
(1)甲烧杯中溶液是_______(填“饱和”或“不饱和”)溶液。
(2)由以上实验可得出结论:影响物质溶解度的因素有_______、__________.
(3)将乙烧杯中的溶液降温到t1。C时,硝酸钾的溶解度是______g/100g水。再往乙烧杯中加入10g水,改变温度至t2 C时,溶液又恰好达到饱和状态,则t1____t2(填“>”、“<”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。
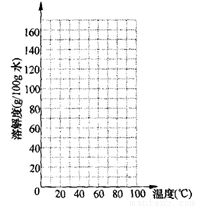
(5)分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时________。C.
(6)请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
|
温度 |
溶解度(g/100g水) |
|
20 |
31.6 |
|
40 |
63.9 |
|
50 |
145 |
|
60 |
110 |
|
70 |
140 |
|
80 |
169 |
(1)饱和 (2)温度 (3)溶剂种类 (4)40.0 (5)> (6)50

【解析】(1)在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做这种溶质的饱和溶液。在一定温度下,向一定量溶剂里加入某种溶质,当溶质能继续溶解时,所得的溶液叫做这种溶质的不饱和溶液。在甲中,烧杯内存在未溶解的硝酸钾晶体,说明硝酸钾在现有条件无法继续溶解,所以甲烧杯中的溶液是饱和溶液。
(2)甲、乙相比可知,甲中有少量的硝酸钾晶体,乙中没有硝酸钾晶体;二者水的质量相同,水的温度不同。可以看出硝酸钾晶体的溶解度受温度的影响。
(3)甲、丙相比可知,甲中有少量的硝酸钾晶体,丙中存有较多的硝酸钾晶体;二者温度相同,甲的溶剂是水,丙的溶剂是酒精,二者的质量相同。可以看出硝酸钾晶体的溶解度受溶剂种类的影响。
(4)乙烧杯中的溶液降温到t1℃时,溶液恰好饱和。
设t1℃时,硝酸钾的溶解度为x,则

可解得,x=40.0g
(5)再往乙烧杯中加入10g水,改变温度至t2 ℃时,溶液又恰好达到饱和状态。说明t2 ℃溶液达到饱和状态时,比t1℃时溶剂(水)多了10g,即t2℃时硝酸钾的溶解度小于t1℃时。根据硝酸钾的溶解度变化特点可知t1>t2.
(6)由表中数据可知,硝酸钾在水中的溶解度随着温度的增加而不断升高。其中50℃时,数据明显不符合此规律,所以50。C时硝酸钾溶解度数据可能存在较大的误差。
绘制溶解度曲线时,先根据表中数据进行描点(50℃不能采用表中数据),再将描的点用平滑的曲线进行连接。
考点:溶解度及溶解度曲线
点评:要准确掌握溶解度、溶解度曲线的意义(点、线)。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验.
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如图所示.
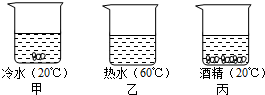
(1)甲烧杯中溶液是______(填“饱和”或“不饱和”)溶液.
(2)由以上实验可得出结论:影响物质溶解度的因素有______、______.
(3)将乙烧杯中的溶液降温到t1℃时,溶液恰好达到饱和状态.则t1℃时,硝酸钾的溶解度是______g/100g水.再往乙烧杯中加入10g水,改变温度至t2℃时,溶液又恰好达到饱和状态,则t1______t2(填“>”、“<”或“=”).
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据.
| 温度 | 溶解度(g/100g水) |
| 20 | 31.6 |
| 40 | 63.9 |
| 50 | 145 |
| 60 | 110 |
| 70 | 140 |
| 80 | 169 |
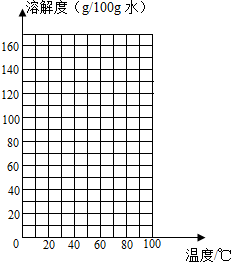
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线______.
某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验。
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。

(1) 甲烧杯中溶液是 (填“饱和”或“不饱和”)溶液。
(2) 由以上实验可得出结论:影响物质溶解度的因素有_______、__________.
(3) 将乙烧杯中的溶液降温到t2。C时,硝酸钾的溶解度是______g/100g水。再往乙烧杯中加入10g水,改变温度至t2 C时,溶液又恰好达到饱和状态,则t1____t2(填“>”、“<”或“=”)。
(4)  经实验测定,获得不同温度时硝酸钾的溶解度数据。
经实验测定,获得不同温度时硝酸钾的溶解度数据。
| 温度 | 溶解度(g/100g水) |
| 20 | 31.6 |
| 40 | 63.9 |
| 50 | 14 |
| 60 | 110 |
| 70 | 140 |
| 80 | 169 |
分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时________。C.
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。
某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验。
在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如下图所示。

(1)甲烧杯中溶液是 (填“饱和”或“不饱和”)溶液。
(2)由以上实验可得出结论:影响物质溶解度的因素有_______、__________.
(3)将乙烧杯中的溶液降温到t2℃时,硝酸钾的溶解度是______g/100g水。再往乙烧杯中加入10g水,改变温度至t2 ℃时,溶液又恰好达到饱和状态,则t1____t2 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)经实验测定,获得不同温度时硝酸钾的溶解度数据。
| 温度 |
|
| 20 | 31.6 |
| 40 | 63.9 |
| 50 | 14 |
| 60 | 110 |
| 70 | 140 |
| 80 | 169 |
分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度时________℃.
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。



 5
5 溶解度(g/100g水)
溶解度(g/100g水) 5
5