题目内容
【题目】对实验室制取![]() 反应后滤液的相关探究:
反应后滤液的相关探究:
![]() 块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的
块状石灰石和适量稀盐酸反应至气泡逸出不明显后,过滤,测得滤液的![]() .则滤液呈________性,滤液中所含的主要离子有________.
.则滤液呈________性,滤液中所含的主要离子有________.
![]() 因后续实验需要,现要配制质量分数为
因后续实验需要,现要配制质量分数为![]() 的碳酸钠溶液
的碳酸钠溶液![]() .
.
①计算:需要碳酸钠固体的质量为________![]() ;水的体积为________
;水的体积为________![]() (水的密度近似看作
(水的密度近似看作![]() )
)
②称量:调节托盘天平平衡后,将碳酸钠放在托盘天平的左盘,称量其质量.然后在右盘添加烧杯,最后加碳酸钠固体,直至天平平衡.
③溶解:用量筒量取所需的水,倒入装有碳酸钠固体的烧杯里,用玻璃棒搅拌,使其溶解,并冷却至室温.
④存储:把配好的溶液装入试剂瓶,塞好橡皮塞并贴好标签,放到指定的地方.
![]() 取
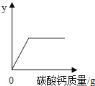
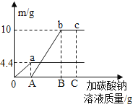
取![]() 滤液,逐滴滴入上述配制的碳酸钠溶液,根据实验测得的数据绘制出如图(纵坐标
滤液,逐滴滴入上述配制的碳酸钠溶液,根据实验测得的数据绘制出如图(纵坐标![]() 是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量).请计算
是实验得到的沉淀或气体的质量,横坐标表示的是碳酸钠溶液质量).请计算![]() 点时溶液的溶质质量分数.(保留一位小数)
点时溶液的溶质质量分数.(保留一位小数)
【答案】酸性Ca2+、Cl-、H+53147
【解析】
(1)实验室中用石灰石和稀盐酸反应来制取二氧化碳,该反应生成了氯化钙、水和二氧化碳,其中氯化钙在溶液中以钙离子和氯离子的形式存在,而水以水分子的形式存在,二氧化碳逸出;根据溶液的pH值和溶液的酸碱性的关系可以知道,pH=2的溶液为酸性溶液,还有氢离子;
(2)①现要配制质量分数为26.5%的碳酸钠溶液200g,需要碳酸钠固体的质量为:200g×26.5%=53g;水的质量为:200g-53g=147g,即为147mL;
(3)盐酸和碳酸钠反应生成气体,而沉淀为碳酸钠和氯化钙的反应生成的,但是碳酸钙可以溶于盐酸中,所以必须把盐酸消耗完全才能生成碳酸钙沉淀,结合图中数据可以知道当滴入10g碳酸钠溶液时盐酸被消耗完毕,即开始产生了沉淀,最后生成沉淀的质量为10g;则:设生成4.4gCO2需要Na2CO3的质量为a,同时生成NaCl的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
a x 4.4g
![]() x=11.7g,
x=11.7g,
![]() a=10.6g,
a=10.6g,
设生成10gCaCO3需要Na2CO3的质量为b,同时生成NaCl的质量为y,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
b 10g y
![]() y=11.7g,
y=11.7g,
![]() b=10.6g,
b=10.6g,
b点时消耗Na2CO3溶液的质量=(10.6g+10.6g)÷26.5%=80g,则b点时溶液的溶质质量分数=![]() ×100%=20.2%;
×100%=20.2%;
答:b点时溶液的溶质质量分数为20.2%。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某同学想探究二氧化锰在过氧化氢分解中作催化剂,设计了以下探究实验,请你完成实验报告和实验分析.![]() 实验报告:
实验报告:
实验步骤 | 用带火星的木条检验时的现象 | 结论 |
| 不复燃 | 几乎无氧气放出 |
| ________ | ________ |
| ________ | ________ |
| ________ | ________ |
| ________ | ________ |
![]() 实验分析
实验分析
①比较步骤![]() 和步骤
和步骤![]() 可得出结论:过氧化氢溶液不加热几乎无氧气放出,稍加热有氧气放出.
可得出结论:过氧化氢溶液不加热几乎无氧气放出,稍加热有氧气放出.
②比较步骤![]() 和步骤
和步骤![]() 可得出结论:________
可得出结论:________
③比较步骤![]() 和步骤
和步骤![]() 可得出结论:________
可得出结论:________
![]() 该同学觉得该实验还不完美.他还想证明
该同学觉得该实验还不完美.他还想证明![]() 在反应前后质量不变,你认为他该增加什么实验________?
在反应前后质量不变,你认为他该增加什么实验________?