题目内容
某化合物4.6g完全燃烧,生成8.8g二氧化碳和5.4g水,该化合物中
- A.只含碳、氢两种元素
- B.只含碳、氧两种元素
- C.含有碳、氢、氧三种元素
- D.无法确定
C
分析:根据二氧化碳中C的质量分数和生成8.8g二氧化碳,即可计算出该化合物中C的质量,根据水中H的质量分数和生成5.4g水,即可计算出该化合物中H的质量,然后根据质量守恒定律,(在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和)计算出该化合物中O的质量.据此选择即可.
解答:该化合物中C的质量为:8.8g×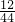 =2.4g;
=2.4g;
该化合物中H的质量为:5.4g×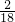 =0.6g;
=0.6g;
该化合物中O的质量为:4.6g-2.4g-0.6g=1.6g.
由此可以判断,该化合物中含有碳、氢、氧三种元素.
故选C.
点评:本题主要考查学生灵活运用化学式和元素的质量分数公式和质量守恒定律进行计算判断的能力.
分析:根据二氧化碳中C的质量分数和生成8.8g二氧化碳,即可计算出该化合物中C的质量,根据水中H的质量分数和生成5.4g水,即可计算出该化合物中H的质量,然后根据质量守恒定律,(在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和)计算出该化合物中O的质量.据此选择即可.
解答:该化合物中C的质量为:8.8g×
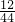 =2.4g;
=2.4g;该化合物中H的质量为:5.4g×
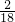 =0.6g;
=0.6g;该化合物中O的质量为:4.6g-2.4g-0.6g=1.6g.
由此可以判断,该化合物中含有碳、氢、氧三种元素.
故选C.
点评:本题主要考查学生灵活运用化学式和元素的质量分数公式和质量守恒定律进行计算判断的能力.

练习册系列答案
相关题目