题目内容
原煤燃烧产生的二氧化硫是造成大气污染的重要原因.二氧化硫又是重要的化工原料,可以生产硫酸,在工业上有重要用途.用硫生产硫酸的总反应可以表示为;2S+3O2+2H2O=2H2SO4.某工厂有含硫0.8%的原煤10000t,回答下列问题.
(1)如未经处理,完全燃烧会产生污染物二氧化硫________t.
(2)如将所含的硫全部转化为硫酸可以得到纯硫酸多少吨?(写出计算过程)
解:(1)10000t原煤含硫的质量为:10000t×0.8%=80t,
设完全燃烧会产生污染物二氧化硫的质量为x,
S+O2 SO2
SO2
32 64
80t x
∴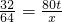 ,
,
解之得:x=160t;
故答案为:160;
(2)设可以得到纯硫酸的质量为y,
2S+3O2+2H2O=2H2SO4.
64 196
80t y
∴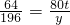 ,
,
解之得:y=245t.
答:如将所含的硫全部转化为硫酸可以得到纯硫酸245吨.
分析:(1)利用硫和氧气反应的化学方程式,就可计算出完全燃烧会产生污染物二氧化硫的质量;
(2)利用硫生产硫酸的化学方程式和硫的质量,列出比例式,就可计算出如将所含的硫全部转化为硫酸可以得到纯硫酸的质量.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是正确运用化学方程式.计算时要注意格式.
设完全燃烧会产生污染物二氧化硫的质量为x,
S+O2
 SO2
SO232 64
80t x
∴
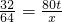 ,
,解之得:x=160t;
故答案为:160;
(2)设可以得到纯硫酸的质量为y,
2S+3O2+2H2O=2H2SO4.
64 196
80t y
∴
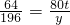 ,
,解之得:y=245t.
答:如将所含的硫全部转化为硫酸可以得到纯硫酸245吨.
分析:(1)利用硫和氧气反应的化学方程式,就可计算出完全燃烧会产生污染物二氧化硫的质量;
(2)利用硫生产硫酸的化学方程式和硫的质量,列出比例式,就可计算出如将所含的硫全部转化为硫酸可以得到纯硫酸的质量.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是正确运用化学方程式.计算时要注意格式.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目