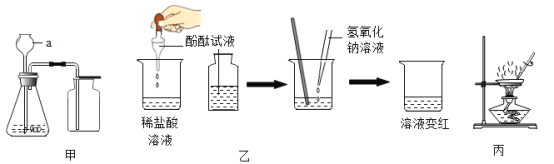
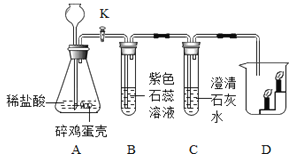
��Ŀ����
����Ŀ��ij�����Ӻ�ͭ�����л���ͭ�������������£���ʾ��ͭ���պ�Ĺ��������ϡ���ᷴӦ��������ͭ��ˮ����ͭ�����У���ͭ���������ʲ���������ϡ���ᷴӦ�Ҳ�����ˮ����
��1������������跢����Ӧ�Ļ�ѧ����ʽ_____��
��2������I��������_____��������I����������Һ�к��е�����_____�����������ţ���H2O��
��3�������Լ�X�����I����������Һ������Ӧ��д����صĻ�ѧ����ʽ___����дһ����
��4���벹�������ɹ�������Y�õ�ͭ�۵�ʵ�鷽�������������Y��_____����ˮϴ�ӹ���2~3�Σ�����õ�ͭ�ۡ�
���𰸡�CuO+H2SO4=CuSO4+H2O ���� Cu2+��H+��SO42 Fe+H2SO4=FeSO4+H2�� ��Fe+CuSO4=FeSO4+Cu ��������������ͭ��Һ��ϡ���ᣬ��ַ�Ӧ�����
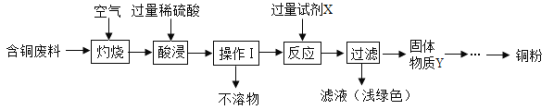
��������
��1����ͭ�����ڿ��������գ�ͭ���ʺ�����������Ӧ��������ͭ�������������������ͭ��ϡ���ᷴӦ��������ͭ��ˮ����ѧ����ʽΪ��CuO+H2SO4=CuSO4+H2O��
��2�����˿��Խ������Թ������Һ�з�����������Բ�����������ǹ��ˣ���������м����ϡ�����ǹ����ģ����Բ���������������Һ�к��е����У�Cu2+��H+��SO42��H2O��
��3���������ᷴӦ����������������������������ͭ��Ӧ��������������ͭ����ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2����Fe+CuSO4=FeSO4+Cu��
��4����������Y�к������ɵ�ͭ�ͷ�Ӧʣ������������Ժ�����ͭ��Һ��ϡ���ᷴӦ��ͭ�������߷�Ӧ���������������Y�м�������������ͭ��Һ��ϡ���ᣬ��ַ�Ӧ����ˣ���ˮϴ�ӹ���2��3�Σ�����õ�ͭ�ۡ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��Ԫ�����ڱ��ͻ�ѧ���ﶼ��ѧϰ��ѧ����Ҫ���ߣ��ش��������⣺
3 Li � | 4 Be �� | 5 B �� | 6 C ̼ | 7 N �� | 8 O �� | 9 F �� | 10 Ne �� |
11 Na �� | 12 Mg þ | 13 Al �� | 14 Si �� | 15 P �� | 16 S �� | 17 Cl �� | 18 Ar � |
��1��ͬһ����(����)�У���������Ԫ�ص�������֮��Ϊ_____����Ԫ��ԭ�Ӻ��������Ϊ_____��
��2���� 7 ��Ԫ����� 8 ��Ԫ����ɵ�һ�ֻ������У�7 ��Ԫ���� 8 ��Ԫ�ص�������Ϊ 7��4����û�����Ļ�ѧʽ��_____��
��3��9 ��Ԫ�ص����嵥��(F2)��������ˮ������Ӧ�����������(HF)����һ����ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ��_____