题目内容
(2010?西宁)为测定某造纸厂排放的废水中氢氧化钠的质量分数,取一定量的该废水于烧杯中,逐滴加入 l0%的硫酸溶液49g恰好完全反应,反应后溶液质量为149g.(假设废水中的其他成分不与硫酸反应)请计算:(1)49g 10%的硫酸溶液中溶质的质量.
(2)废水中氢氧化钠的质量分数.
【答案】分析:(1)利用溶质质量=溶液质量×溶液中溶质的质量分数,计算49g 10%的硫酸溶液中溶质的质量;
(2)利用恰好完全反应所消耗硫酸的质量,根据反应的化学方程式,计算废水中氢氧化钠的质量,利用质量守恒定律计算所取废水质量;最后利用溶液中溶质的质量分数公式计算出废水中氢氧化钠的质量分数.
解答:解:(1)49g 10%的硫酸溶液中溶质硫酸的质量=49g×10%=4.9g
(2)设反应消耗NaOH的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 4.9g
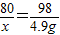 x=4g
x=4g
废水中氢氧化钠的质量分数=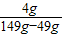 ×100%=4%
×100%=4%
答:质量分数为4%.
点评:根据质量守恒定律,反应后溶液的质量与所加入稀硫酸的质量差即所取废水溶液的质量.
(2)利用恰好完全反应所消耗硫酸的质量,根据反应的化学方程式,计算废水中氢氧化钠的质量,利用质量守恒定律计算所取废水质量;最后利用溶液中溶质的质量分数公式计算出废水中氢氧化钠的质量分数.
解答:解:(1)49g 10%的硫酸溶液中溶质硫酸的质量=49g×10%=4.9g
(2)设反应消耗NaOH的质量为x
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 4.9g
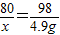 x=4g
x=4g废水中氢氧化钠的质量分数=
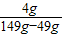 ×100%=4%
×100%=4%答:质量分数为4%.
点评:根据质量守恒定律,反应后溶液的质量与所加入稀硫酸的质量差即所取废水溶液的质量.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
 (2010?西宁)(1)如图是甲、乙两种固体物质的溶解度曲线.根据图示回答:
(2010?西宁)(1)如图是甲、乙两种固体物质的溶解度曲线.根据图示回答: (2010?西宁)甲、乙、丙、丁四种物质在一定条件下的转化关系如图所示.请结合你已有的知识,回答下列问题:
(2010?西宁)甲、乙、丙、丁四种物质在一定条件下的转化关系如图所示.请结合你已有的知识,回答下列问题: