��Ŀ����
ʵ���ҳ�������װ���о����ʵ���ȡ�����ʣ�������ѧ֪ʶ�ش��������⣮��1��I����ͼʵ��װ���в��������շ�����ԭ������
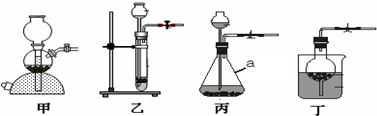
II����д������װ��������a�����ƣ�a
III��ʵ������˫��ˮ��Һ�Ͷ���������ȡ���������ü�װ�õ�ԭ����
��2������ͼѡ��ʵ������ȡ���ռ�������̼��װ��Ϊ
��ע��װ�õ����������ã�
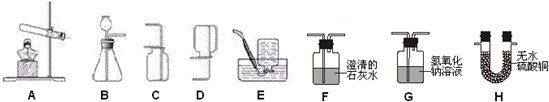
��3��ijʵ��̽��С�����õڶ�С��ͼ�ṩ�����ʵ��װ�ý�������̽�����̣���ʵ���һ����ṩ�Թܡ����ܡ�ϡ���ᡢп����
������⣺���ȷ��ͭ�̡�Cu2��OH��2CO3���������ȷֽ�IJ��
���м��裺ͭ�����ȷֽ�IJ���Ϊ����ͭ��������̼��ˮ��
���ʵ�飺
ʵ��٣����ȷֽ����ͭ�̣�����֤�ж�����̼��ˮ���ɣ���һ����ʵ��װ������˳�����ң���
ʵ��ڣ��������ʵ�飨Ҫ��д��ʵ�鲽�衢��������ۣ���֤��ͭ�����ȷֽ�����Թ���ʣ��ĺ�ɫ����������ͭ�������ֱ�������
ʵ����������ۣ�ʵ����У�֤���������ж�����̼��ʵ��������
������I�����շ�����֮�����ܿ��Ʒ�Ӧ�Ľ�����ֹͣ��������Ϊ������װ���еĵ����ܹرպ����ɵ�����ʹװ���е���ѹ���Ӷ�ʹ�����Һ����룬ʹ��Ӧֹͣ�����ݸ�ԭ��ѡ��װ�ã�
����������ƿ��
��1�����������ǹ�̬��ĩ����Һ�岻���룬���ݷ�Ӧ��д������ʽ��
��2��ʵ������ȡ������̼��ʯ��ʯ��ϡ���ᷴӦ������Һ�����ͣ�������̼������ˮ���ܶȱȿ���������ʼ�ղ���ʹ����ʯ��ˮ����ǣ�����������Ũ�ȹ���
��3�����ʵ�飺��������ˮ����ͭ����ɫ������ˮ�����ɫ���壬������̼��ʹ�����ʯ��ˮ����ǵ����Խ��
�ڸ��������غ㶨�ɿ�֪����ɫ�������������ͭ����̼������ͭ��ϡ������������ͭ��ˮ��
ʵ����������ۣ��������ƺͶ�����̼����̼��ƺ�ˮ��
����������ƿ��
��1�����������ǹ�̬��ĩ����Һ�岻���룬���ݷ�Ӧ��д������ʽ��
��2��ʵ������ȡ������̼��ʯ��ʯ��ϡ���ᷴӦ������Һ�����ͣ�������̼������ˮ���ܶȱȿ���������ʼ�ղ���ʹ����ʯ��ˮ����ǣ�����������Ũ�ȹ���
��3�����ʵ�飺��������ˮ����ͭ����ɫ������ˮ�����ɫ���壬������̼��ʹ�����ʯ��ˮ����ǵ����Խ��
�ڸ��������غ㶨�ɿ�֪����ɫ�������������ͭ����̼������ͭ��ϡ������������ͭ��ˮ��
ʵ����������ۣ��������ƺͶ�����̼����̼��ƺ�ˮ��
����⣺I����Ϊ���շ����������ܹرգ�Һ�屻ѹ��©�������еĵ��ܹرպ����彫����ѹ�س���©���У���Ӧֹͣ�����еĹ�������������ײ������Բ���ʹ��Һ���룻���еĵ����ܱ��رպ����ɵ������ܽ�����ѹ���ձ����Ӷ�ʹ��Һ���룬��Ӧֹͣ��
������ѧ������֪������Ϊ��ƿ��
��1�����������ǹ�̬��ĩ����Һ�岻���룬�ʲ���ѡ�ü���ȡ����Ӧ����ʽΪ��2H2O2
2H2O+O2����
��2��ʵ������ȡ������̼��ʯ��ʯ��ϡ���ᷴӦ������Һ�����ͣ��Ҷ�����̼������ˮ���ܶȱȿ������������ſ�������ѡȡװ��ΪB��C��ʵ������ȡ������̼�Ļ�ѧ����ʽ��CaCO3+2HCl�TCaCl2+CO2��+H2O������ʼ�ղ���ʹ����ʯ��ˮ����ǣ�����������Ũ�ȹ��������Ȼ������壬��ʯ��ˮ��Ӧ���Ӷ�ʹʯ��ˮ������ǣ�
��3�����ʵ�飺�ټ��ȷֽ����ͭ�̣�˵������װ�����ڹ���������װ�ã���ˮ����ͭ����ɫ������ˮ�����ɫ���壬������̼��ʹ�����ʯ��ˮ����ǣ��ʴ�Ϊ��AHF��
�ڸ��������غ㶨�ɿ�֪����ɫ�������������ͭ����̼������ͭ��ϡ������������ͭ��ˮ����Һ��Ϊ��ɫ�����Կɸ�����Һ�Ƿ�����ɫ�ж��Ƿ�������ͭ��
ʵ����������ۣ��������ƺͶ�����̼����̼��ƺ�ˮ�����Կ��Կ��������ʯ��ˮ����ǣ�
�ʴ�Ϊ��
I������
�������̳ʷ�ĩ״��2H2O2
2H2O+O2����
��2��B��C�� CaCO3+2HCl�TCaCl2+CO2��+H2O������Ũ�ȹ��������Ȼ������壻
��3����A��H��F��
��ȡ�������岢װ���Թ��У�Ȼ�����ϡ�����Ӧ���ɫ������ʧ����Һ�����ɫ��Һ��˵����ɫ����������ͭ�������ʯ��ˮ����ǣ�
������ѧ������֪������Ϊ��ƿ��
��1�����������ǹ�̬��ĩ����Һ�岻���룬�ʲ���ѡ�ü���ȡ����Ӧ����ʽΪ��2H2O2
| ||
��2��ʵ������ȡ������̼��ʯ��ʯ��ϡ���ᷴӦ������Һ�����ͣ��Ҷ�����̼������ˮ���ܶȱȿ������������ſ�������ѡȡװ��ΪB��C��ʵ������ȡ������̼�Ļ�ѧ����ʽ��CaCO3+2HCl�TCaCl2+CO2��+H2O������ʼ�ղ���ʹ����ʯ��ˮ����ǣ�����������Ũ�ȹ��������Ȼ������壬��ʯ��ˮ��Ӧ���Ӷ�ʹʯ��ˮ������ǣ�
��3�����ʵ�飺�ټ��ȷֽ����ͭ�̣�˵������װ�����ڹ���������װ�ã���ˮ����ͭ����ɫ������ˮ�����ɫ���壬������̼��ʹ�����ʯ��ˮ����ǣ��ʴ�Ϊ��AHF��
�ڸ��������غ㶨�ɿ�֪����ɫ�������������ͭ����̼������ͭ��ϡ������������ͭ��ˮ����Һ��Ϊ��ɫ�����Կɸ�����Һ�Ƿ�����ɫ�ж��Ƿ�������ͭ��
ʵ����������ۣ��������ƺͶ�����̼����̼��ƺ�ˮ�����Կ��Կ��������ʯ��ˮ����ǣ�
�ʴ�Ϊ��
I������
�������̳ʷ�ĩ״��2H2O2
| ||
��2��B��C�� CaCO3+2HCl�TCaCl2+CO2��+H2O������Ũ�ȹ��������Ȼ������壻
��3����A��H��F��
��ȡ�������岢װ���Թ��У�Ȼ�����ϡ�����Ӧ���ɫ������ʧ����Һ�����ɫ��Һ��˵����ɫ����������ͭ�������ʯ��ˮ����ǣ�
������������Ҫ�������������ȡԭ����װ��ѡ�������������ӣ����շ�������ԭ����ѧ�����ʵ�鲢�������ʵ���ɵķ���������ȫ�棬����������ѧ��������������������

��ϰ��ϵ�д�
 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
�����Ŀ


 ��ͼ��ʵ���ҳ��õ�ʵ����������ش��������⣺
��ͼ��ʵ���ҳ��õ�ʵ����������ش��������⣺