题目内容
不纯的锌6克(含杂质金属M)和不纯的铁6克(含杂质金属N),当它们分别与足量的稀硫酸反应到不再有氢气产生,得到的氢气都是0.2克.则M、N可能是
- A.M为Mg,N为Cu
- B.M为Fe,N为Al
- C.M为Al,N为Mg
- D.M为Cu,N为Mg
A
分析:假设加入的都是纯净的金属6g,根据锌和稀硫酸反应的化学方程式和铁和稀硫酸反应的化学方程式计算产生的氢气的质量,然后与0.2克比较分析解答.
解答:假设加入的金属锌和铁都是6g纯净的金属锌和铁
设6克锌全参加反应生成氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
6g x
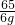 =
=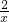
x=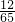 g<0.2g
g<0.2g
设m克铁全参加反应生成氢气的质量为y
Fe+H2SO4=FeSO4+H2↑
56 2
6g y
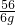 =
=
y= g>0.2g
g>0.2g
因为等质量的铝镁铁锌产生氢气的质量铝>镁>铁>锌,铜不能和稀硫酸反应产生氢气,所以锌中杂质金属等质量的产生氢气应该比等质量的金属锌多,铁中杂质金属应比等质量的铁产生的氢气少或不产生氢气,故答案选A
点评:本题解题的构建是分析出等质量的金属铝镁铁锌产生氢气的质量的大小关系,然后才有假设法假设杂质金属是纯净的金属求出生成氢气的质量再和0.2g比较分析得出杂质金属产生氢气质量应该比等质量的原金属产生氢气的质量大小即可得出答案.
分析:假设加入的都是纯净的金属6g,根据锌和稀硫酸反应的化学方程式和铁和稀硫酸反应的化学方程式计算产生的氢气的质量,然后与0.2克比较分析解答.
解答:假设加入的金属锌和铁都是6g纯净的金属锌和铁
设6克锌全参加反应生成氢气的质量为x
Zn+H2SO4=ZnSO4+H2↑
65 2
6g x
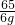 =
=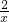
x=
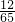 g<0.2g
g<0.2g设m克铁全参加反应生成氢气的质量为y
Fe+H2SO4=FeSO4+H2↑
56 2
6g y
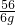 =
=
y=
 g>0.2g
g>0.2g因为等质量的铝镁铁锌产生氢气的质量铝>镁>铁>锌,铜不能和稀硫酸反应产生氢气,所以锌中杂质金属等质量的产生氢气应该比等质量的金属锌多,铁中杂质金属应比等质量的铁产生的氢气少或不产生氢气,故答案选A
点评:本题解题的构建是分析出等质量的金属铝镁铁锌产生氢气的质量的大小关系,然后才有假设法假设杂质金属是纯净的金属求出生成氢气的质量再和0.2g比较分析得出杂质金属产生氢气质量应该比等质量的原金属产生氢气的质量大小即可得出答案.

练习册系列答案
 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目