��Ŀ����
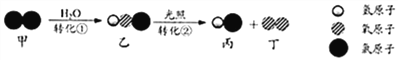
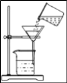
����Ŀ��������һ�ֱ�����Դ�������ÿ����з�����ĵ����ϳɰ������ϳɰ�����ᷢչ�� ������������˾��ף������Ǻϳɰ��Ĺ�������ͼ��
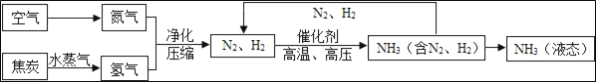
��1���ϳɰ�����ĵ������Կ���������Һ̬�������Եõ�������
��ȡ�����ķ�Ӧ����Ϊ����C+H2O![]() CO+H2��CO+H2O
CO+H2��CO+H2O![]() CO2+H2
CO2+H2
������Ӧ���б��ֻ�ԭ�Ե�������_____���ѧʽ������Ӧ������ CO2���ɣ�������; ��_____����дһ�ּ��ɣ�
��2��������������д�� N2�� H2��Ӧ����NH3�Ļ�ѧ����ʽ_____��
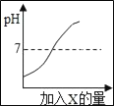
��3�����е㲻ͬ��������뿪����������Һ�����뷨���磬�����¶��ک�183��ʱ���ɽ�������N2��O2���룬��һ������_____�仯������������������ѧ�����������±������ʵķе��жϣ�Ҫ������ NH3�� N2��H2���뿪�����¶�Ӧ�ÿ�����_____�����¡�
���� | H2 | N2 | O2 | NH3 |
�е� | ��252�� | ��195.8�� | ��183�� | ��33.35�� |
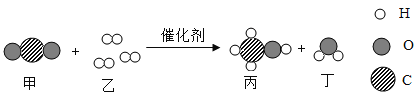
��4������![]() ���ֱ��ʾ N2��H2��NH3���۲�������ͼ��ѡ�����Ϻϳɰ���ѧ��Ӧ���̵���˳��ͼ������������ͼ��������У�_____��
���ֱ��ʾ N2��H2��NH3���۲�������ͼ��ѡ�����Ϻϳɰ���ѧ��Ӧ���̵���˳��ͼ������������ͼ��������У�_____��
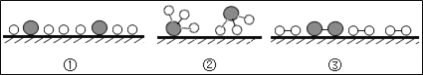
���𰸡�C ���� N2+3H2![]() 2NH3 ���� ��33.35 �ۢ٢ڡ���
2NH3 ���� ��33.35 �ۢ٢ڡ���
��������
��1����C+H2O![]() CO+H2��CO+H2O
CO+H2��CO+H2O![]() CO2+H2������̼�õ���Ԫ������һ����̼�����Ա��ֻ�ԭ�ԣ����Է�Ӧ���б��ֻ�ԭ�Ե����ʵĻ�ѧʽΪ C����Ӧ������ CO2���ɣ����ڶ�����̼ʱ������õ�ԭ�ϣ�ͬʱ��ȼ��Ҳ��֧��ȼ�գ����Կ����������ȣ�����������;�����ȡ�
CO2+H2������̼�õ���Ԫ������һ����̼�����Ա��ֻ�ԭ�ԣ����Է�Ӧ���б��ֻ�ԭ�Ե����ʵĻ�ѧʽΪ C����Ӧ������ CO2���ɣ����ڶ�����̼ʱ������õ�ԭ�ϣ�ͬʱ��ȼ��Ҳ��֧��ȼ�գ����Կ����������ȣ�����������;�����ȡ�
��2��������������д�� N2�� H2��Ӧ����NH3����Ӧ�Ļ�ѧ����ʽΪ N2+3H2![]() 2NH3��
2NH3��
��3�����е㲻ͬ��������뿪����������Һ�����뷨���磬�����¶��ک�183��ʱ���ɽ������� N2�� O2���룬��һ����û�����������ɣ������������仯�������±������ʵķе��жϣ�Ҫ������ NH3�� N2��H2���뿪�������ڵ����������������ķе㶼�Ȱ����ͣ�ֻ��Ҫ�����ک�33.35�����¾Ϳ���ʵ�ְ���֮������ʶ������壬������ΪҺ��������롣
��4�����Ƿ�Ӧ��Ӵ�������Ȼ������Ϊԭ�ӣ����Ϊ���ӣ��뿪���������Է��Ϻϳɰ���ѧ��Ӧ���̵���˳��ͼ�ۢ٢ڡ�
�ʴ�Ϊ��
��1��C�����ȡ�
��2��N2+3H2![]() 2NH3��
2NH3��
��3����������33.35�档
��4���ۢ٢ڡ�

����Ŀ��̼����泥�NH4HCO3�����׳ơ�̼李�����ũ�峣�õĵ��ʡ�NH4HCO3������ˮ���������ֽ⣬�����������ʣ�����⣬�����������������£�
������ | ������� |
�����һ�� | ��ɫ��ζ��Һ�壬�������ܼ� |
��������� | ��ʹ����ʯ��ˮ����ǵ����塣 |
��������� | �д̼�����ζ�����壬ˮ��Һ�ʼ��ԡ� |
��1����д��̼��������ȷֽ�Ļ�ѧ����ʽ��_____��
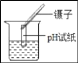
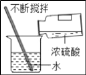
��2����Ԥ��̼����淋Ļ�ѧ���ʣ�˵��Ԥ������ݣ������ʵ����֤��
��ѡ�Լ��ǣ�̼����立�ĩ����ʯ�ҡ�ʳ�Ρ�ϡ���ᡢ��ɫʯ����Һ��̿�ۡ�þ��������ͭ��
Ԥ�� | Ԥ������� | ��֤Ԥ���ʵ�������Ԥ������ |
���ܹ������෴Ӧ | ̼������������̼��������� | ȡ����̼����立�ĩ���Թ��У�����������_____������۲쵽_____����Ԥ������� |
���ܹ���_____����������𣩷�Ӧ | _____ | ȡ����̼����立�ĩ_____�����_____����Ԥ������� |