题目内容
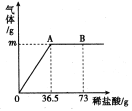
【题目】某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。
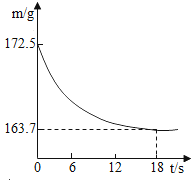
求:(1)生成CO2的质量。
(2)该纯碱样品中Na2CO3的质量分数。
【答案】(1)8.8g (2)80%
【解析】试题分析:(1)根据质量守恒定律可知,减少固体的质量即为产生二氧化碳质量;(2)根据二氧化碳质量,利用化学方程式进行计算得出碳酸钠质量,再用碳酸钠质量除以样品质量即可。具体步骤如下:
解:(1)生成二氧化碳质量=172.5g-163.7g=8.8g
(2)设该纯碱样品中碳酸钠质量为X
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 44
X 8.8g
106/44="X/" 8.8g X=21.2g
所以纯碱样品中碳酸钠的质量分数=21.2g/26.5g×100%=80%
答:略

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
【题目】某石油化工厂化验室的实验员用20%的氢氧化钠溶液洗涤一定量石油产品中的残余稀硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)当PH》7时,溶液中的溶质是 。
(3)若一定量石油产品中残余稀硫酸的质量为100g,请计算该残余稀硫酸的溶质质量分数。(写 出详细的计算过程)