题目内容
某同学实验时,用氢气还原16克氧化铜,反应一段时间后,停止加热,冷却后称量剩余固体质量为14.4g,则下列结论正确的是( )
分析:氢气和氧化铜反应生成了铜和水,分析反应的特点可以知道,反应前后固体质量差为氧化铜在反应中失去氧元素的质量,失去的氧元素与氢化合成水,因此,由氧元素质量可计算生成水的质量,消耗掉的氧化铜的质量,可以据此完成该题的解答.
解答:解:分析反应的特点可以知道,反应前后固体质量差为氧化铜在反应中失去氧元素的质量,其质量为16g-14.4g=1.6g:
设,生成水的质量为x,生成铜的质量为y,参加反应的氧化铜的质量为z
H2+CuO
Cu+H2O 固体质量减少
80 64 18 16
z y x 1.6g
=
=
=
解得:x=1.8g y=6.4g z=8g
A、根据上述解答可以知道生成水的质量为1.8g,故A结论错误;
B、根据上述解答生成铜的质量为6.4g,故B结论错误;
C、根据质量守恒定律可以知道反应中和氧化铜反应的氢气的质量为:1.8g-1.6g=0.2g
根据反应的特点可知道,在反应前应该先通入氢气,再加热,反应结束时为了防止生成的铜被氧化,应该先停止加热再停止通入氢气,且反应过程中通入的氧气不能被完全消耗,所以实际用去的氢气的质量要大于0.2g,故C结论正确;
D、参加反应的氧化铜的质量分数为:
×100%=50%,故D结论错误.
故选C.
设,生成水的质量为x,生成铜的质量为y,参加反应的氧化铜的质量为z
H2+CuO
| ||
80 64 18 16
z y x 1.6g
| 18 |
| x |
| 64 |
| y |
| 80 |
| z |
| 16 |
| 1.6g |
解得:x=1.8g y=6.4g z=8g
A、根据上述解答可以知道生成水的质量为1.8g,故A结论错误;
B、根据上述解答生成铜的质量为6.4g,故B结论错误;
C、根据质量守恒定律可以知道反应中和氧化铜反应的氢气的质量为:1.8g-1.6g=0.2g
根据反应的特点可知道,在反应前应该先通入氢气,再加热,反应结束时为了防止生成的铜被氧化,应该先停止加热再停止通入氢气,且反应过程中通入的氧气不能被完全消耗,所以实际用去的氢气的质量要大于0.2g,故C结论正确;
D、参加反应的氧化铜的质量分数为:
| 8g |
| 16g |
故选C.
点评:根据化学方程式进行计算时,所使用的物质的质量必须为完全反应时物质的质量,未参加反应的物质的质量不能代入化学方程式进行计算.

练习册系列答案
相关题目
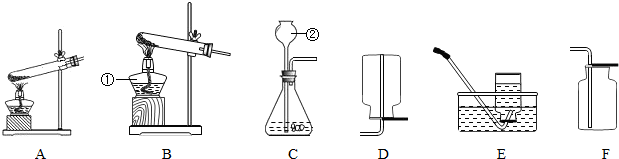
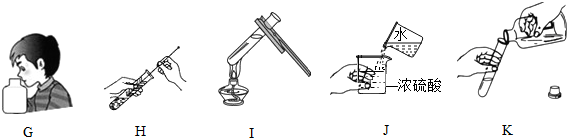
 某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收).
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了如图所示的装置,进行有关的实验探究(提示:氢气和氧化铁在高温条件下发生置换反应,杂质不参加反应,浓硫酸具有吸水性,假定每步均完全反应或吸收).