题目内容
2005年5月22日上午11时08分,中国登山测量队成功登上珠峰峰顶,这是继1975年后我国再次对珠穆朗玛峰高度进行准确测量.氢化钙(CaH2)固体是登山队员常用的能源,用它和水反应生成氢氧化钙和氢气[CaH2+2H2O═Ca(OH)2+2H2↑],氢气供燃烧之需.请回答下列问题:
(1)CaH2中钙元素为+2价,氢元素的化合价为________.
(2)现有87.5g含CaH2质量分数为96%的氢化钙样品与足量水反应,可生成多少克氢气?
解:(1)设氢化钙中氢元素的化合价为x.
(+2)+x×2=0
x=-1;
故答案为:-1
(2)生成氢气的质量为y.
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
87.5g×96% y
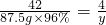 ,
,
y=8g
答:可生成8g氢气
分析:(1)根据CaH2中钙元素为+2价,化合物中元素的化合价的代数和为零可求得氢元素的化合价.
(2)由氢化钙的质量和质量分数根据氢化钙与水反应的化学方程式可以计算出生成氢气的质量.
点评:本题主要考查有关化学式的计算和含杂质物质的化学方程式计算,难度较大.
(+2)+x×2=0
x=-1;
故答案为:-1
(2)生成氢气的质量为y.
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
87.5g×96% y
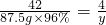 ,
,y=8g
答:可生成8g氢气
分析:(1)根据CaH2中钙元素为+2价,化合物中元素的化合价的代数和为零可求得氢元素的化合价.
(2)由氢化钙的质量和质量分数根据氢化钙与水反应的化学方程式可以计算出生成氢气的质量.
点评:本题主要考查有关化学式的计算和含杂质物质的化学方程式计算,难度较大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目