题目内容
生产中不小心将铁粉和碳粉混合在一起.为测定其组成,取一定量混合物在足量氧气中灼烧,发现灼烧后所得固体与所取混合物质量相等,则混合物中铁粉的质量分数为
- A.27.6%
- B.72.4%
- C.80%
- D.82.4%
B
分析:碳在空气中充分灼烧后会燃烧生成二氧化碳气体(碳粉完全消失),铁粉在氧气中充分灼烧会生成四氧化三铁(铁粉质量增加).所以完全灼烧后的固体成分只有四氧化三铁.根据题意,完全灼烧后得到固体质量与原混合物相同,所以原混合物中碳粉的质量就等于与铁粉发生反应的氧气的质量.
解答:根据题意,完全灼烧后得到固体质量与原混合物相同,所以原混合物中碳粉的质量就等于与铁粉发生反应的氧气的质量.
C+O2 CO2
CO2
3Fe+2O2 Fe3O4
Fe3O4
168:64
168:64=21:8
所以原混合物中铁粉与碳粉质量之比为 21:8;
则原混合物中铁粉的质量分数为: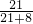 ×100%=72.4%;
×100%=72.4%;
故选B.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
分析:碳在空气中充分灼烧后会燃烧生成二氧化碳气体(碳粉完全消失),铁粉在氧气中充分灼烧会生成四氧化三铁(铁粉质量增加).所以完全灼烧后的固体成分只有四氧化三铁.根据题意,完全灼烧后得到固体质量与原混合物相同,所以原混合物中碳粉的质量就等于与铁粉发生反应的氧气的质量.
解答:根据题意,完全灼烧后得到固体质量与原混合物相同,所以原混合物中碳粉的质量就等于与铁粉发生反应的氧气的质量.
C+O2
 CO2
CO23Fe+2O2
 Fe3O4
Fe3O4168:64
168:64=21:8
所以原混合物中铁粉与碳粉质量之比为 21:8;
则原混合物中铁粉的质量分数为:
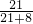 ×100%=72.4%;
×100%=72.4%;故选B.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目