题目内容
【题目】化学是一门以实验为基础的学科 
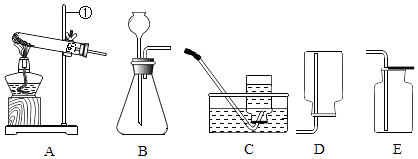
【实验一】常见气体的制取.如图1所示
(1)仪器a的名称 .
(2)实验室用A装置制取氧气,从燃烧条件分析,加热过程中试管内的棉花没有燃烧的原因是 . 选择E装置收集氧气的理由是 .
(3)实验室常用锌与稀硫酸来制取氢气,反应的化学方程式为 , 氢气验纯时,最好选用方法来收集氢气,再点燃试验.
(4)【实验二】对比归纳是学习化学的重要方法.如图2所示 实验A:②中反应更剧烈,可知影响硫燃烧剧烈程度的因素是 .
(5)实验B:④中固体消失,③中固体几乎不溶,可知影响物质溶解性的因素是
【答案】
(1)集气瓶
(2)温度没有达到着火点;氧气不易溶于水
(3)Zn+H2SO4═ZnSO4+H2↑;排水
(4)氧气的浓度
(5)溶剂的性质
【解析】解:(1)据图可以看出,该仪器是集气瓶,故填:集气瓶;(2)加热过程中试管内的棉花没有燃烧是因为温度未达到棉花的着火点;选择E装置收集氧气是因为氧气不易溶于水,故填:温度没有达到着火点;氧气不易溶于水;(3)实验室常用锌与稀硫酸来制取氢气,锌与稀硫酸反应生成硫酸锌和氢气,氢气验纯时,最好选用排水法收集,故填:Zn+H2SO4=ZnSO4+H2↑;排水;(4):②中反应更剧烈,可以知道氧气的浓度会影响反应的剧烈程度,故填:氧气的浓度; (5)④中固体消失,③中固体几乎不溶,说明溶剂的性质影响物质溶解性,故填:溶剂的性质.
【考点精析】通过灵活运用氧气的化学性质和制取氧气的操作步骤和注意点,掌握氧气的化学性质:特有的性质:支持燃烧,供给呼吸;制取氧气的操作步骤(以高锰酸钾制取氧气并用排水法收集为例)a、步骤:查—装—定—点—收—移—熄即可以解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下图是一氧化碳与氧化铁反应的装置图,根据图示回答有关问题: 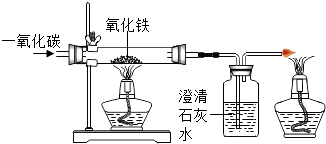
(1)写出一氧化碳与氧化铁反应的化学方程式;
(2)根据此实验可知一氧化碳与二氧化碳的化学性质是不同的,请根据你的认识写出两点: ①②
(3)某小组同学欲检验一氧化碳还原氧化铁生成的固体是铁(不考虑有氧化铁剩余),请你简述他们可能设计的一种化学实验方案(包括实验现象、操作和结论)
实验操作 | 实验现象 | 实验结论 |
一氧化碳还原氧化铁生成的固体是铁 |
【题目】为探究气体X的组成,某兴趣小组进行如图所示实验(固定装置未画出). 【实验装置】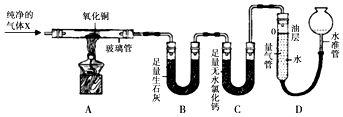
【查阅资料】
①加热条件下,气体X能与氧化铜反应生成铜、水和氮气.
②生石灰与气体X不反应,无水氯化钙可吸收气体X.
③本实验条件下,装置内空气中的水、二氧化碳的影响可忽略不计.
【实验步骤】
①连接仪器,并检查装置气密性.
②准确称取2.40g氧化铜,装入A装置的玻璃管中,并在B、C、D中装入相应物质.
③测量并记录反应前的相关数据Ⅰ(见表).
④连接A、B、C装置,将气体X缓缓通入一段时间后,连接上D装置,再开始加热.(利用装置D中液面在反应前、后的刻度差,可测得生成的氮气的体积)
⑤当A装置中氧化铜反应完全后,停止加热,并继续通入气体X至玻璃管冷却.,再次测量并记录反应后的相关数据Ⅱ.
数据编号 | Ⅰ | Ⅱ |
玻璃管(含药品)的质量/g | 54.40 | 53.92 |
B装置(含药品)的质量/g | 104.00 | 104.54 |
氮气的质量/g | / | 0.28 |
【相关数据】
注:如表中氮气的质量是通过D装置收集的氮气体积,并通过氮气的密度计算得到.
【回答问题】
(1)B装置中氧化钙吸水的原理为(用化学方程式表示).
(2)实验中,A装置的玻璃管中可观察到的现象是 . 当观察到量气管内液面 , 说明氧化铜已完全反应.停止加热,继续通入气体X至玻璃管冷却的目的是 .
(3)分析实验测量的数据,生成水的质量为g,氧化铜中氧元素的质量为g.由此推知,气体X中(填“有”或“没有”或“可能有”)氧元素.
(4)气体X的化学式为 .