题目内容
【题目】向10g大理石样品(杂质不溶于水,也不与盐酸反应)分两次加入一定溶质质量分数的稀盐酸,充分反应后烧杯内物质总质量变化如图所示。
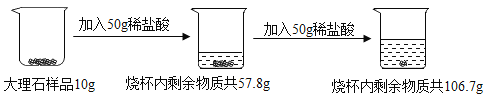
请计算:
(1)该大理石样品中碳酸钙的质量分数是_____;
(2)计算所用稀盐酸的溶质质量分数;_____
【答案】75% 7.3%
【解析】
根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,减少的为气体的质量。
根据质量守恒定律可得,生成的二氧化碳的总质量为![]()
由于加入第一个50g稀盐酸对应2.2g二氧化碳,所以生成3.3g二氧化碳时消耗的盐酸的质量为75g。
设该大理石样品中碳酸钙的质量分数为x,所用稀盐酸的溶质质量分数为y
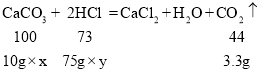
![]()
![]()
答:大理石样品中碳酸钙的质量分数为75%,所用稀盐酸的溶质质量分数为7.3%。

练习册系列答案
相关题目
【题目】在化学实验室,老师为同学们准备了三瓶没有贴标签的试剂(稀硫酸、氢氧化钠溶液和氯化钡溶液),已知氯化钡溶液呈中性。同学们自主进行探究实验。化学课代表小李同学的实验过程如下:
(1)将三瓶试剂分别标记为A、B、C,然后两两混合,观察和记录实验现象。
实验编号 | 甲 | 乙 | 丙 |
实验操作 |
|
|
|
实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 |
根据上述实验现象可知:C中溶质的化学式是_____;A和B发生了化学反应,不能肯定C与A,C与B发生了化学反应。
(2)验证C分别与A、B是否发生化学反应。
①实验操作和现象如图

②实验结论
试剂X的名称是_____,C与_____发生了化学反应。
(3)实验结束后,将实验甲、乙、丙三支试管中的物质倒入同一个烧杯中,充分搅拌、静置、过滤,所得滤液中肯定含有的溶质是_____(填化学式)。