题目内容
学校实验室内有瓶放置时间较长的过氧化氢溶液,为测算该溶液中过氧化氢的质量分数:现取50g样品,加入2g MnO2完全反应后,剩余物质质量为50.4g。
计算(1)生成氧气的质量。
(2)样品中过氧化氢的质量分数。
计算(1)生成氧气的质量。
(2)样品中过氧化氢的质量分数。
(1)1.6g(1分)(2)6.8%
试题分析:(1)根据质量守恒定律反应前后质量不变可知,生成的氧气的质量为:50g+2g-50.4g=1.6g
(2)解:设过氧化氢的质量为x
2 H2O2
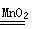 2H2O+ O2 ↑
2H2O+ O2 ↑ 68 32
X 1.6g
68:32=x:1.6g
解得 x="3.4g"
3.4g ÷ 50g × 100% =" 6.8%"
答:生成氧气的质量为1.6g;样品中过氧化氢的质量分数为6.8%

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2H2↑+ O2 ↑)
2H2↑+ O2 ↑)
