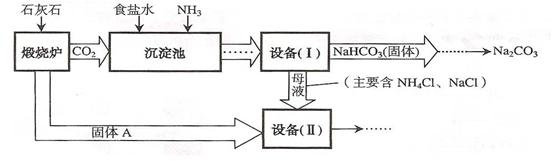
题目内容
在含有较多NH4+、Ba2+、NO3ˉ、Clˉ的溶液中还能大量共存的离子是( )
| A.Ag+ | B.Mg2+ | C.SO42ˉ | D.OHˉ |
B
试题分析:所谓大量共存就是离子间相互结合不能形成沉淀、气体、水,其实就是分解反应发生的条件,A、Ag+会与Clˉ结合形成AgCl白色沉淀,不能大量共存,错误,B、正确,C、SO42ˉ会与Ba2+结合形成BaSO4白色沉淀,不能大量共存,错误,D、OHˉ会与NH4+结合形成氨水,氨水不稳定,分解产生氨气和水,不能大量共存,错误,故选B

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目