题目内容
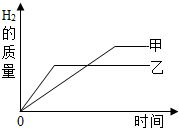 把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( )
把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( )| A、甲的活动性比乙强 |
| B、甲的相对原子质量比乙大 |
| C、反应消耗等质量的硫酸 |
| D、反应消耗等质量的金属 |
考点:金属的化学性质
专题:金属与金属材料
分析:等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,说明酸是足量的;由产生H2的质量随时间变化的趋势图,可以确定生成氢气的质量;进而结合金属的活动性越强,与酸反应的速率越快,进行分析判断.
解答:解:A、由产生H2的质量随时间变化的趋势图,等质量的甲、乙两种金属粉末,至完全反应,乙用的时间少,甲用的时间多,由金属的活动性越强,与酸反应的速率越快,则金属活动性顺序乙>甲,故选项说法错误.
B、由等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),分别与足量稀硫酸反应,由于化合价相同,产生的氢气质量与金属的相对原子质量成反比,产生氢气质量越多,说明该金属的相对原子质量越小,则相对原子质量甲<乙,故选项说法错误.
C、由质量守恒定律,氢气来源于酸中的氢,生成的氢气质量不同,说明消耗硫酸的质量不同,故选项说法错误.
D、加入等质量的甲、乙两种金属粉末,反应后金属都没有剩余,说明反应消耗等质量的金属,故选项说法正确.
故选:D.
B、由等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),分别与足量稀硫酸反应,由于化合价相同,产生的氢气质量与金属的相对原子质量成反比,产生氢气质量越多,说明该金属的相对原子质量越小,则相对原子质量甲<乙,故选项说法错误.
C、由质量守恒定律,氢气来源于酸中的氢,生成的氢气质量不同,说明消耗硫酸的质量不同,故选项说法错误.
D、加入等质量的甲、乙两种金属粉末,反应后金属都没有剩余,说明反应消耗等质量的金属,故选项说法正确.
故选:D.
点评:本题难度不大,掌握活动性强的金属与酸反应剧烈、在相同时间内放出氢气的速度快是正确解答本题的关键.

练习册系列答案
相关题目
下列变化属于化学变化的是( )
| A、苹果腐烂 | B、石蜡熔化 |
| C、木棍折断 | D、汽油挥发 |
 图中甲、乙、丙是初中化学常见的物质,用“-”连接的两种物质在溶液中可发生化学反应,下列说法不正确的是( )
图中甲、乙、丙是初中化学常见的物质,用“-”连接的两种物质在溶液中可发生化学反应,下列说法不正确的是( )| A、甲可以为盐 |
| B、乙只能是氧化物或酸 |
| C、丙只能是金属单质、盐或碱 |
| D、其中一个反应可能同时生成两种沉淀 |
下列说法错误的是( )
| A、洗涤剂可乳化餐具上的油污 |
| B、汽油可溶解衣服上的油渍 |
| C、氢氧化钠溶液可直接用作厨房清洁剂 |
| D、食醋可用于除去水壶中的水垢 |
下列有关实验现象描述正确的是( )
| A、氢气在空气中燃烧,产生淡蓝色的白烟 |
| B、木炭在氧气中燃烧,生成了二氧化碳 |
| C、硫在空气中燃烧,发出微弱的淡蓝色火焰 |
| D、铁丝伸入装有氧气的集气瓶中,剧烈燃烧、火星四射 |
下列实验操作正确的是( )
A、 |
B、 |
C、 |
D、 |
2013年6月5日是“世界环境日”,中国主题为“同呼吸共奋斗”,空气的质量越来越受到人们的关注.下列各组气体都属于空气的污染物的是( )
| A、CO2、N2 |
| B、NO2、O2 |
| C、CO、CO2 |
| D、SO2、NO2 |