题目内容
某化学兴趣小组在学习金属活动性顺序后,对金属钠能否像铁一样把铜从硫酸铜溶液中置换出来产生了兴趣,并进行了一下探究:【提出问题】钠与硫酸铜溶液反应后的产物中是否有铜?
【查阅资料】①钠能与冷水剧烈反应,放出大量热.化学方程式为:2Na+2H2O═2NaOH+H2↑
②难溶性碱通常遇热时会分解,如:Cu(OH)2
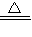 CuO+H20.
CuO+H20.【分析讨论】经讨论,大家认为钠可能会先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜.但也有可能钠直接与硫酸铜反应而生成铜.
【提出猜想】小组同学对钠与硫酸铜溶液反应的产物作出如下猜想:
猜想1:有Cu(OH)2和H2,无Cu;
猜想2:有Cu,无Cu(OH)2和H2;
猜想3:既有Cu(OH)2和H2,又有Cu.
【探究实验一】
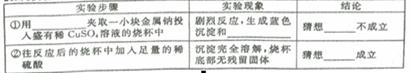
| 实验步骤 | 实验现象 | 结论 |
| ①用 夹取一小块金属钠投入盛有稀CuSO4溶液的烧杯中 | 剧烈反应,生成蓝色沉淀和 | 猜想 不成立 |
| ②往反应后的溶液中加入足量的稀硫酸 | 沉淀完全溶解,烧杯底部无残留固体 | 猜想 成立 |
【探究实验二】
| 实验步骤 | 实验现象 | 结论 |
| ③将一小块金属钠投入盛有饱和 CuSO4溶液的烧杯中 | 反应更加剧烈,除出现与实验一相同的现象外,还生成了少量的黑色沉淀物 | 黑色沉淀物是 , 钠与CuSO4饱和溶液反应的产物中也没有铜 |
| ④ | 蓝色沉淀和黑色沉淀物均完全溶解,烧杯底部无残留固体 |
【答案】分析:【探究实验一】
取块状固体用镊子;依据氢气是无色无味的气体及题目的猜想和物质性质分析解答;
【探究实验二】
根据题目信息进行分析:钠与水反应放出热量,氢氧化铜分解生成黑色的氧化铜;
依据氧化铜和氢氧化铜与硫酸可以反应,而铜与硫酸不反应分析解答.
解答:解:【探究实验一】
取块状固体用镊子;根据反应现象:生成蓝色沉淀,说明有氢氧化铜生成,也就说明钠与水反应生成氢气和氢氧化钠,然后氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜;氢气是无色无味的气体,通过实验现象从而证明了猜想2是错误的;
氢氧化铜与稀硫酸可以反应,加入稀硫酸后沉淀全部溶解,说明固体中无铜,因为铜与硫酸不反应,故猜想3错误,猜想2正确;
故答案为:
【探究实验二】
根据题目信息:钠与水反应放出热量,从而使生成的氢氧化铜分解而成黑色的氧化铜;
依据氧化铜和氢氧化铜与硫酸可以反应,而铜与硫酸不反应;可以向反应后的烧杯中加入足量的稀硫酸观察是否全部溶解,从而确定是否含有铜;进而确定未能得到铜是否与(CuSO4)溶液浓度有关;
故答案为:
点评:本题重点考查了学生分析信息,结合相关知识及操作中的描述和反应现象,分析解决问题的能力.
取块状固体用镊子;依据氢气是无色无味的气体及题目的猜想和物质性质分析解答;
【探究实验二】
根据题目信息进行分析:钠与水反应放出热量,氢氧化铜分解生成黑色的氧化铜;
依据氧化铜和氢氧化铜与硫酸可以反应,而铜与硫酸不反应分析解答.
解答:解:【探究实验一】
取块状固体用镊子;根据反应现象:生成蓝色沉淀,说明有氢氧化铜生成,也就说明钠与水反应生成氢气和氢氧化钠,然后氢氧化钠和硫酸铜反应生成蓝色沉淀氢氧化铜;氢气是无色无味的气体,通过实验现象从而证明了猜想2是错误的;
氢氧化铜与稀硫酸可以反应,加入稀硫酸后沉淀全部溶解,说明固体中无铜,因为铜与硫酸不反应,故猜想3错误,猜想2正确;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| ①镊子 | 无色(无味的)气体. | 2 |
| 1 |
根据题目信息:钠与水反应放出热量,从而使生成的氢氧化铜分解而成黑色的氧化铜;
依据氧化铜和氢氧化铜与硫酸可以反应,而铜与硫酸不反应;可以向反应后的烧杯中加入足量的稀硫酸观察是否全部溶解,从而确定是否含有铜;进而确定未能得到铜是否与(CuSO4)溶液浓度有关;
故答案为:
| 实验步骤 | 实验现象 | 结论 |
| CuO(或氧化铜). | ||
| ④往反应后的烧杯中加入足量的稀硫酸 |
点评:本题重点考查了学生分析信息,结合相关知识及操作中的描述和反应现象,分析解决问题的能力.

练习册系列答案
相关题目
某化学兴趣小组在学习金属活动性顺序后,对金属钠能否像铁一样把铜从硫酸铜溶液中置换出来产生了兴趣,并进行了一下探究:
【提出问题】钠与硫酸铜溶液反应后的产物中是否有铜?
【查阅资料】①钠能与冷水剧烈反应,放出大量热.化学方程式为:2Na+2H2O═2NaOH+H2↑
②难溶性碱通常遇热时会分解,如:Cu(OH)2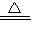 CuO+H20.
CuO+H20.
【分析讨论】经讨论,大家认为钠可能会先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜.但也有可能钠直接与硫酸铜反应而生成铜.
【提出猜想】小组同学对钠与硫酸铜溶液反应的产物作出如下猜想:
猜想1:有Cu(OH)2和H2,无Cu;
猜想2:有Cu,无Cu(OH)2和H2;
猜想3:既有Cu(OH)2和H2,又有Cu.
【探究实验一】
【反思质疑】有同学认为未能得到铜可能是(CuSO4)溶液浓度太小的缘故,并为此作了进一步的实验探究.
【探究实验二】
【拓展分析】金属钠不能将铜等金属从其盐溶液中置换出来.
【提出问题】钠与硫酸铜溶液反应后的产物中是否有铜?
【查阅资料】①钠能与冷水剧烈反应,放出大量热.化学方程式为:2Na+2H2O═2NaOH+H2↑
②难溶性碱通常遇热时会分解,如:Cu(OH)2
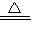 CuO+H20.
CuO+H20.【分析讨论】经讨论,大家认为钠可能会先与水反应生成氢氧化钠和氢气,氢氧化钠再与硫酸铜反应生成氢氧化铜.但也有可能钠直接与硫酸铜反应而生成铜.
【提出猜想】小组同学对钠与硫酸铜溶液反应的产物作出如下猜想:
猜想1:有Cu(OH)2和H2,无Cu;
猜想2:有Cu,无Cu(OH)2和H2;
猜想3:既有Cu(OH)2和H2,又有Cu.
【探究实验一】
| 实验步骤 | 实验现象 | 结论 |
| ①用 夹取一小块金属钠投入盛有稀CuSO4溶液的烧杯中 | 剧烈反应,生成蓝色沉淀和 | 猜想 不成立 |
| ②往反应后的溶液中加入足量的稀硫酸 | 沉淀完全溶解,烧杯底部无残留固体 | 猜想 成立 |
【探究实验二】
| 实验步骤 | 实验现象 | 结论 |
| ③将一小块金属钠投入盛有饱和 CuSO4溶液的烧杯中 | 反应更加剧烈,除出现与实验一相同的现象外,还生成了少量的黑色沉淀物 | 黑色沉淀物是 , 钠与CuSO4饱和溶液反应的产物中也没有铜 |
| ④ | 蓝色沉淀和黑色沉淀物均完全溶解,烧杯底部无残留固体 |

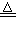 CuO+H2O。
CuO+H2O。
