题目内容
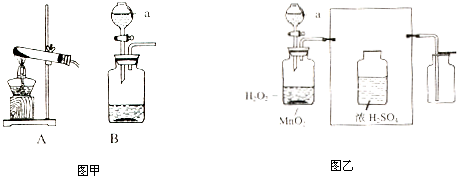
图甲、图乙是实验室制取气体的常用的发生装置,据图回答下列问题: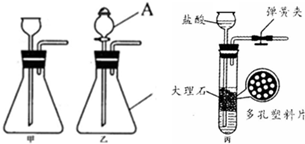
(1)写出A、B仪器的名称A________;B________.
(2)实验时,乙装置比甲装置的优点是________.
(3)制取氧气时,A中放的药品是________;B中盛放________.(填药品的名称)
(4)制取二氧化碳时,A中放的药品是________;B中盛放________(填药品的名称).该反应的化学符号表达式是:________.
(5)图丙是小红为制备CO2的改进发生装置图.
①该装置的特点是:打开弹簧夹,固液药品接触,发生反应;关闭弹簧夹后,________,停止反应.用该装置制备 CO2可以起到________的效果.
②实验中长颈漏斗下端管口应伸到液面下,这是为了________.
③检查这套装置气密性的方法是________,________.
④晓军认为可以用小红的装置去制取氧气,我认为________(填“可以”或“不可以”),理由________.
解:(1)分液漏斗可以控制反应的发生和停止,锥形瓶常用的反应容器,故答案为:分液漏斗;锥形瓶.
(2)乙中用的是分液漏斗,分液漏斗可以控制反应的发生和停止,故答案为:可以控制反应速率.
(3)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,故答案为:双氧水溶液;二氧化锰.
(4)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;故答案为:稀盐酸;大理石或石灰石.CaCO3+2HCl=CaCl2+H2O+CO2↑
(5)图丙装置的特点是:打开弹簧夹,固液药品接触,发生反应;关闭弹簧夹后,固液药品分离,停止反应.用该装置制备 CO2可以起到随开随用,随关随停的效果;实验中长颈漏斗下端管口应伸到液面下,这是为了液封,便于酸倒流实现分离;检查这套装置气密性的方法是:关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;不可以用小红的装置去制取氧气,因为二氧化锰是粉末状固体;故答案为:①固液药品分离,随开随用,随关随停.②液封,便于酸倒流实现分离.③关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;④不可以;二氧化锰是粉末状固体.
分析:分液漏斗可以控制反应的发生和停止,锥形瓶常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.图丙装置的特点是:打开弹簧夹,固液药品接触,发生反应;关闭弹簧夹后,固液药品分离,停止反应.用该装置制备 CO2可以起到随开随用,随关随停的效果;实验中长颈漏斗下端管口应伸到液面下,这是为了液封,便于酸倒流实现分离;检查这套装置气密性的方法是:关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;不可以用小红的装置去制取氧气,因为二氧化锰是粉末状固体.
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和检查装置的气密性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.
(2)乙中用的是分液漏斗,分液漏斗可以控制反应的发生和停止,故答案为:可以控制反应速率.
(3)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,故答案为:双氧水溶液;二氧化锰.
(4)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;故答案为:稀盐酸;大理石或石灰石.CaCO3+2HCl=CaCl2+H2O+CO2↑
(5)图丙装置的特点是:打开弹簧夹,固液药品接触,发生反应;关闭弹簧夹后,固液药品分离,停止反应.用该装置制备 CO2可以起到随开随用,随关随停的效果;实验中长颈漏斗下端管口应伸到液面下,这是为了液封,便于酸倒流实现分离;检查这套装置气密性的方法是:关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;不可以用小红的装置去制取氧气,因为二氧化锰是粉末状固体;故答案为:①固液药品分离,随开随用,随关随停.②液封,便于酸倒流实现分离.③关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;④不可以;二氧化锰是粉末状固体.
分析:分液漏斗可以控制反应的发生和停止,锥形瓶常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.图丙装置的特点是:打开弹簧夹,固液药品接触,发生反应;关闭弹簧夹后,固液药品分离,停止反应.用该装置制备 CO2可以起到随开随用,随关随停的效果;实验中长颈漏斗下端管口应伸到液面下,这是为了液封,便于酸倒流实现分离;检查这套装置气密性的方法是:关闭弹簧夹,向长颈漏斗中注入一定量的水形成液柱,静置后,看液柱是否下降,若下降,则气密性不好,反之则好;不可以用小红的装置去制取氧气,因为二氧化锰是粉末状固体.
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和检查装置的气密性等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
图—1是实验室制取二氧化碳气体的装置图,请回答下列问题:
①写出仪器A的名称 (1) 。
②检查此装置的气密性时,关闭弹簧夹,从仪器A处注入适量的 (2) 形成液封后,若看到仪器A内 (3) ,则表明装置气密性良好。
③为了制得较多的二氧化碳,可对图—1中所示仪器进行改变,请写出你的方法 (4) 。
④同学们在图—1装置不漏气、操作正确、加入药品足量且质量相等的情况下同时进行了实验,
以下是他们的的实验记录:
请分析产生上述两种现象的可能的原因:
甲同学: (5) ;乙同学: (6) 。
经过以上实验分析,你认为影响反应速度快慢的因素有 (7) 等。
丙同学重新选择药品,进行实验并观察到产生气泡速度适中。但是将产生气体通入足量的澄清石灰水,澄清石灰水不浑浊。请你分析可能的原因: (8) ;
⑤同学们在图—1装置中添加了多孔隔板,得到了图—2所示装置。添加多孔隔板的作用是 (9)。 实验过程中,将固体药品放在 (10) (填a或b)处,从A处加入一定量液体,从而产生二氧化碳。若关闭弹簧夹,继续反应产生的二氧化碳会使容器内 (11) ,将液体压回仪器A中,使固体与液体 (12) ,反应即自行停止。
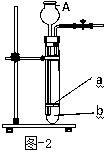
⑥请写出证明二氧化碳气体已经集满的方法 (13) 。
⑦同学们确定了合适的药品进行实验,成功收集到0.01mol二氧化碳气体。实验中消耗了10克盐酸(假设溶质全部反应完),请问该盐酸溶液溶质的质量分数?(根据化学方程式列式计算)
①写出仪器A的名称 (1) 。
②检查此装置的气密性时,关闭弹簧夹,从仪器A处注入适量的 (2) 形成液封后,若看到仪器A内 (3) ,则表明装置气密性良好。
③为了制得较多的二氧化碳,可对图—1中所示仪器进行改变,请写出你的方法 (4) 。
④同学们在图—1装置不漏气、操作正确、加入药品足量且质量相等的情况下同时进行了实验,
以下是他们的的实验记录:
| | 甲 | 乙 |
| 现象 | 产生气泡缓慢并逐渐停止。 | 反应剧烈,产生气泡很快。 |
请分析产生上述两种现象的可能的原因:
甲同学: (5) ;乙同学: (6) 。
经过以上实验分析,你认为影响反应速度快慢的因素有 (7) 等。
丙同学重新选择药品,进行实验并观察到产生气泡速度适中。但是将产生气体通入足量的澄清石灰水,澄清石灰水不浑浊。请你分析可能的原因: (8) ;
⑤同学们在图—1装置中添加了多孔隔板,得到了图—2所示装置。添加多孔隔板的作用是 (9)。 实验过程中,将固体药品放在 (10) (填a或b)处,从A处加入一定量液体,从而产生二氧化碳。若关闭弹簧夹,继续反应产生的二氧化碳会使容器内 (11) ,将液体压回仪器A中,使固体与液体 (12) ,反应即自行停止。

⑥请写出证明二氧化碳气体已经集满的方法 (13) 。
⑦同学们确定了合适的药品进行实验,成功收集到0.01mol二氧化碳气体。实验中消耗了10克盐酸(假设溶质全部反应完),请问该盐酸溶液溶质的质量分数?(根据化学方程式列式计算)
图—1是实验室制取二氧化碳气体的装置图,请回答下列问题:
①写出仪器A的名称 (1) 。
②检查此装置的气密性时,关闭弹簧夹,从仪器A处注入适量的 (2) 形成液封后,若看到仪器A内 (3) ,则表明装置气密性良好。
③为了制得较多的二氧化碳,可对图—1中所示仪器进行改变,请写出你的方法 (4) 。
④同学们在图—1装置不漏气、操作正确、加入药品足量且质量相等的情况下同时进行了实验,
以下是他们的的实验记录:
| | 甲 | 乙 |
| 现象 | 产生气泡缓慢并逐渐停止。 | 反应剧烈,产生气泡很快。 |
请分析产生上述两种现象的可能的原因:
甲同学: (5) ;乙同学: (6) 。
经过以上实验分析,你认为影响反应速度快慢的因素有 (7) 等。
丙同学重新选择药品,进行实验并观察到产生气泡速度适中。但是将产生气体通入足量的澄清石灰水,澄清石灰水不浑浊。请你分析可能的原因: (8) ;
⑤同学们在图—1装置中添加了多孔隔板,得到了图—2所示装置。添加多孔隔板的作用是 (9)。 实验过程中,将固体药品放在 (10) (填a或b)处,从A处加入一定量液体,从而产生二氧化碳。若关闭弹簧夹,继续反应产生的二氧化碳会使容器内 (11) ,将液体压回仪器A中,使固体与液体 (12) ,反应即自行停止。

⑥请写出证明二氧化碳气体已经集满的方法 (13) 。
⑦同学们确定了合适的药品进行实验,成功收集到0.01mol二氧化碳气体。实验中消耗了10克盐酸(假设溶质全部反应完),请问该盐酸溶液溶质的质量分数?(根据化学方程式列式计算)
 (2013?嘉定区一模)图是实验室制取气体的常用装置.请根据要求填空:
(2013?嘉定区一模)图是实验室制取气体的常用装置.请根据要求填空: