题目内容
氢氧化钠固体保存不善会变质而产生碳酸钠.为了除去氢氧化钠中的碳酸钠杂质,兴趣小组最初设计了如下实验方案.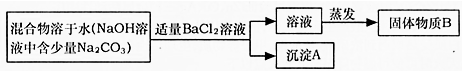
请回答下列问题:
(1)按照此方案得到的固体物质B是______ (填物质的化学式);
(2)你认为要得到较纯净的氢氧化钠固体,应选择除杂试剂是______(填物质的名称),加入该试剂后,分离除去沉淀A的实验操作方法是______.杂质与该试剂反应的化学方程式是______.
解:(1)碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,过滤除去碳酸钡,溶液中含有氢氧化钠和氯化钠,故溶液蒸发后得到的固体B中含有NaOH和NaCl,故答案为:NaOH和NaCl;
(2)除去氢氧化钠中碳酸钠,实质就是除去碳酸根,在不带入新的杂质的要求下,可选择用氢氧化钙溶液或氢氧化钡溶液把碳酸根沉淀出来,反应后还能生成氢氧化钠,不会带入新的杂质.
故答案为:氢氧化钙溶液或(氢氧化钡溶液),过滤. Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
分析:(1)从氯化钡和碳酸钠反应后的生成物分析所得物质的成分;
(2)根据除杂质的原则,在除去杂质的同时不能带入新的杂质角度考虑,分离固液混合物用过滤的方法,书写化学方程式要遵循质量守恒定律.
点评:本题主要考查了碳酸钠和氢氧化钠的性质,难度适中,要求同学们要学会通过化学方程式来解决问题.
(2)除去氢氧化钠中碳酸钠,实质就是除去碳酸根,在不带入新的杂质的要求下,可选择用氢氧化钙溶液或氢氧化钡溶液把碳酸根沉淀出来,反应后还能生成氢氧化钠,不会带入新的杂质.
故答案为:氢氧化钙溶液或(氢氧化钡溶液),过滤. Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
分析:(1)从氯化钡和碳酸钠反应后的生成物分析所得物质的成分;
(2)根据除杂质的原则,在除去杂质的同时不能带入新的杂质角度考虑,分离固液混合物用过滤的方法,书写化学方程式要遵循质量守恒定律.
点评:本题主要考查了碳酸钠和氢氧化钠的性质,难度适中,要求同学们要学会通过化学方程式来解决问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2009?广元)某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
(2009?广元)某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
