题目内容
甲醇是一种有毒、有酒精气味的可燃性液体.甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+nO2
mCO2+2CO+16H2O.若反应生成1.8g水,请计算:
(1)m的值是
(2)参加反应的氧气的质量是多少?(写出规范的计算步骤)
| ||
(1)m的值是
(2)参加反应的氧气的质量是多少?(写出规范的计算步骤)
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变.由已知反应物中C原子总数为8,生成物中C原子总数也应该为为8,则可以求得m=8-2=6,再由生成物氧原子总数和甲醇中氧原子总数可以求出n=11.
(2)由方程式中可以找出参加反应的氧气和生成水的质量比,再由生成水的质量可以求得参加反应的氧气质量.
(2)由方程式中可以找出参加反应的氧气和生成水的质量比,再由生成水的质量可以求得参加反应的氧气质量.
解答:解:(1)m=8-2=6
8+2n=6×2+2+16
n=11
(2)设参加反应的氧气质量为X
8CH3OH+11O2
6CO2+2CO+16H2O
352 288
x 1.8g
=
x=2.2g
答:(1)m值是6;
(2)参加反应的氧气质量是2.2g
8+2n=6×2+2+16
n=11
(2)设参加反应的氧气质量为X
8CH3OH+11O2
| ||
352 288
x 1.8g
| 352 |
| x |
| 288 |
| 1.8g |
x=2.2g
答:(1)m值是6;
(2)参加反应的氧气质量是2.2g
点评:解此类题要依据质量守恒定律,化学反应前后元素种类及原子个数不变,分别统计出反应前后有关原子种类及个数,比较分析可以得出m,n 的值;从而可以写出完整的化学方程式,再根据方程式中各物质之间的质量关系,就可以求出某种未知的物质的质量.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
与其他三种有本质区别的一种性质是( )
| A、颜色 | B、状态 | C、硬度 | D、可燃性 |
图中a、b、c分别表示KNO3、NaCl、Ca(OH)2溶解度曲线,下列说法错误的是( )

| A、T1时,KNO3和NaCl的饱和溶液溶质的质量分数相等 |
| B、T2时,A点表示KNO3的不饱和溶液,降温至T1时有晶体析出,且变为T1时KNO3的饱和溶液 |
| C、T1时,将Ca(OH)2饱和溶液升温至T2变为不饱和溶液 |
| D、温度高于T1时,KNO3溶解度大于NaCl溶解度,温度低于T1时,KNO3溶解度小于NaCl溶解度 |
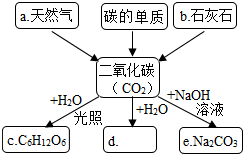 在紧张的复习阶段,对化学知识的梳理有助于提高复习的效率,如图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和生成物省略).请按下列要求填空:
在紧张的复习阶段,对化学知识的梳理有助于提高复习的效率,如图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和生成物省略).请按下列要求填空:

 A为金属单质,B、C、D为三种不同的化合物,物质间相互转化关系如图所示(图中“--表示相连的物质间能发生反应).回答下列问题:
A为金属单质,B、C、D为三种不同的化合物,物质间相互转化关系如图所示(图中“--表示相连的物质间能发生反应).回答下列问题: