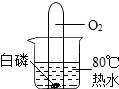
��Ŀ����
����Ŀ��A��G�dz��л�ѧ�������ʣ����У�A��Ũ��Һ�ܻӷ����̼�����ζ�����壬��C��D�ķ�Ӧ����������ɫ�������ɣ�EΪ��ɫ��������ͼ����Щ���ʵ�ת����ϵ�����ַ�Ӧ������P��Ӧ������ʡ�ԣ� 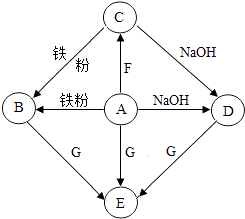
��1����д����ѧʽ��A �� F ��
��2��д��D��E�Ļ�ѧ����ʽ ��
��3����A��E�ķ�Ӧ�����У�A��G��Һǡ����ȫ��Ӧ����Ӧ��������Һ��pH7�����������=����������
��4��C��Һ�����۷�Ӧ��ȡʣ�����������ᣬû������ų����������C�����۷�Ӧ�����Һ����г���H2O�⣬һ�����ڵ������� �� ���ܴ��ڵ������� ��
���𰸡�
��1��HCl��CuO��Cu��OH��2
��2��NaCl+AgNO3=AgCl��+NaNO3
��3����
��4��FeCl2��CuCl2
���������⣺��1��A��G�dz��л�ѧ�������ʣ�A��Ũ��Һ�ܻӷ����̼�����ζ�����壬A�����ۡ��������ƻᷴӦ������A�����ᣬ��C��D�ķ�Ӧ����������ɫ�������ɣ����ݸ��ֽⷴӦԭ����֪C�к���ͭ���ӣ������F�����ɺ���ͭ���ӵ�C������F����������ͭ��������ͭ��C�����Ȼ�ͭ���Ȼ�ͭ���������Ʒ�Ӧ������ɫ��������ͭ�������Ȼ��ƣ�������������Ʒ�ӦҲ�������Ȼ��ƺ�ˮ������D���Ȼ��ƣ��Ȼ�ͭ�����۷�Ӧ�������Ȼ�������ͭ�����������Ӧ�������Ȼ�����������������B���Ȼ�������EΪ��ɫ������A��B��D�ж����������ӣ���G��Ӧ�����ɰ�ɫ����������G����������������֤���Ƴ��ĸ������ʾ��������е�ת����ϵ���Ƶ�����������A��HCl��F��CuO��Cu��OH��2����2��D��E�ķ�Ӧ���Ȼ��ƺ���������Ӧ�����Ȼ��������������ƣ���ѧ����ʽΪ��NaCl+AgNO3=AgCl��+NaNO3����3��ͨ���Ƶ���֪��A�����ᣬG�����������������������Ӧ�����Ȼ������������ᣬ���������ԣ�������A��E�ķ�Ӧ�����У�A��G��Һǡ����ȫ��Ӧ����Ӧ��������Һ��pH��7����4��ͨ���Ƶ���֪C���Ȼ�ͭ���Ȼ�ͭ��Һ�����۷�Ӧ��ȡʣ�����������ᣬû������ų���˵����Ӧ��Ĺ�����û�����ۣ����ۿ��ܸպ����Ȼ�ͭ��Ӧ����ʱ��Һ�е��������Ȼ��������п������۲��㣬û�����Ȼ�ͭ��ȫ��Ӧ����ʱ��Ӧ����������Ȼ��������Ȼ�ͭ������C�����۷�Ӧ�����Һ����г���H2O�⣬һ�����ڵ�������FeCl2 �� ���ܴ��ڵ�������CuCl2 �� ���Դ��ǣ���1��HCl��CuO��Cu��OH��2����2��NaCl+AgNO3=AgCl��+NaNO3����3��������4��FeCl2 �� CuCl2 ��
�����㾫����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪ע�⣺a����ƽ b������ c�����ţ�

����Ŀ�����������ǵ��ճ�����������أ����������������ʹ���˽��������ϲ� �ϣ��������ѧ֪ʶ���й���Ϣ�ش����⣮
��1��������̥��������ѡ���Ȼ�߷��Ӳ��ϡ����л��ϳɲ��ϡ��������ܡ���������ȫ�Ǵٽ��������ϼ���������������������ʹ���˸��ϲ��ϵ���
A�������ĵ��粣����������������֬�����ϵ�ճ�϶��ɣ�
B�����������ո�ʹ�õ�����
C��������ײ�������ŵ��õĸ�ǿ�ȸ�
D����������ʵ���þ�Ͻ�
��2���������һ�������Ͻ�����ô��������ԭ���� ��
��3����Ϣһ���ؿ��к������Ľ���Ԫ��������Ԫ�ط��ţ���
��Ϣ�������Ļ�ѧ���ʺܻ��ã�����������Ʒȴ���ٳ��ָ�ʴ�������û�ѧ����ʽ��ʾ�����е�ԭ�� ��
��Ϣ����
���� | �����ԣ�100Ϊ���� | �ܶȣ�g/cm3�� |
ͭ | 99 | 8.92 |
�� | 17 | 7.87 |
�� | 61 | 2.70 |
�ۺ��������أ���ѡ�ñ������ֽ����е���Ϊ��ѹ����ߣ�ԭ������������㼴�ɣ���
��4�����л�ѧ��ͨ����ѧ��Ӧ�õ����������ķ��������֣�һ����ʪ��ұ�������Ȼ�ͭ���Ȼ�п�Ļ����Һ�м���һ���������ۣ���ַ�Ӧ����ˣ��õ��µĽ�������Һ����Һ��һ�����е����������ѧʽ������һ���ǻ�ұ���罫¯��ʯ��ZnCO3������ͭ��Cu2O����ľ̿�ۻ�Ϻ���¼��ȣ��õ�һ������ƽ��ӵ�п��ͭ�ĺϽ���֪¯��ʯ���ȷֽ�Ļ�ѧ����ʽ��ZnCO3![]() ZnO+CO2������д������п��ͭ��Ӧ�Ļ�ѧ����ʽ �� ��
ZnO+CO2������д������п��ͭ��Ӧ�Ļ�ѧ����ʽ �� ��
����Ŀ����һ�������£�M��������ַ�Ӧ����ˮ�Ͷ�����̼һ���ܱ���������������ˮ��������̼����һ�ֿ�ȼ��M����÷�Ӧǰ������ʵ����������ʾ��������˵��������ǣ� ��
�� �� | ���� | ������̼ | ˮ���� | M |
��Ӧǰ������/g | 55 | 1 | 3 | 23 |
��Ӧ�������/g | 7 | y | 30 | x |
A.����M��һ������C H OԪ��
B.�÷�Ӧ��Ԫ�صĻ��ϼ۽�����
C.����M��һ������C H ���ܺ��� OԪ��
D.Y��ֵ��45