题目内容
(3分)根据元素周期表的部分信息,回答下列问题:
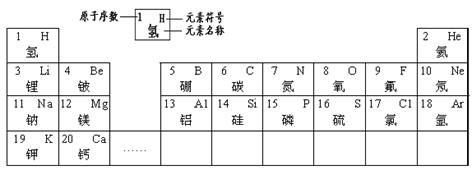
| 1 H 氢 | | | | | | | | 2 He 氦 |
| 3 Li 锂 | 4 Be 铍 | | 5 B 硼 | 6 C 碳 | 7 N 氮 | 8 O 氧 | 9 F 氟 | 10 Ne 氖 |
| 11 Na 钠 | 12 Mg 镁 | | 13 Al 铝 | 14 Si 硅 | 15 P 磷 | 16 S 硫 | 17 Cl 氯 | 18 Ar 氩 |
(2)元素周期表同一横行元素的排列规律是:从左至右
(3)表中不同种元素最本质的区别是 (填序号):
A、质子数不同 B、中子数不同 C、相对原子质量不同
(1)Al2O3 (2)金属元素→非金属元素→稀有气体元素(合理即可) (3)A
解析试题分析:(1)原子序数为8、13号的元素分别是O、Al,已知Al的化合价为+3价,O的化合价为-2价,根据“正价在左,负价在右”的书写规则,结合化合价的原则,“在化合物中,正负化合价的代数和为零”,可知氧化铝的化学式为Al2O3。
(2)根据元素周期表可知,同一横行元素的排列规律是从左至右:原子序数(核电荷数)依次增大。
(3)根据元素的概念分析,元素是具有相同核电荷数或质子数的一类原子的总称,故表中不同种元素最本质的区别是质子数不同,故选A。
考点:元素周期表的特点及其应用,化学式的书写及意义,化合价规律和原则
点评:解答本题的关键是要理解和熟练掌握化学式的写法,理解元素周期表的特点,并能在解题中灵活应用。

(6分)元素周期表是学习化学的重要工具,下表是元素周期表的一部分。请回答下列问题:
|
1 H |
|
2 He |
|||||
|
3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
|
11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
(1)元素周期表中不同种元素最本质的区别是 (填序号)。
A.相对原子质量不同
B.质子数不同
C.中子数不同
(2)镁元素的原子结构示意图为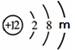 , 则m = ,该原子在化学反应中易
, 则m = ,该原子在化学反应中易
(填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
(3)元素周期表中每一个横行叫做一个周期。以第二周期为例,根据图-6该周期中各元素的原子结构示意图,分析同一周期元素之间的排列有一定的规律,如: (填序号)。
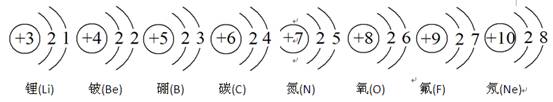
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素的原子序数依次递增
C.从左到右,各元素原子的最外层电子数相同
(4)由1号和8号元素组成的化合物(分子中原子个数比为2:1)与6号元素的单质,在高温下发生置换反应,生成一种最轻的气体和一种由双原子分子构成的化合物,该反应的化学方程式是__ __。
 ,其中x为
,其中x为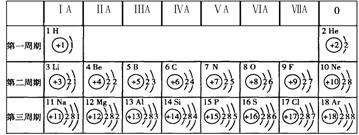
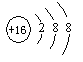 如左图的结构示意图表示的是 (写粒子符号)。
如左图的结构示意图表示的是 (写粒子符号)。

 如左图的结构示意图表示的是 (写粒子符号)。
如左图的结构示意图表示的是 (写粒子符号)。