题目内容
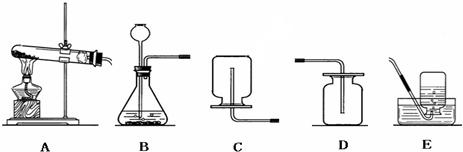
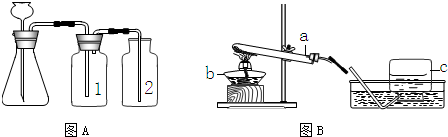
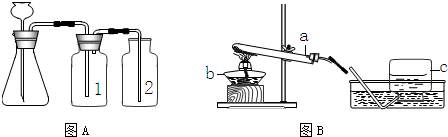
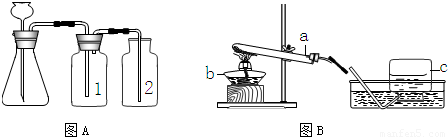
(1)实验室常用下图A与B装置支取气体,回答下列问题: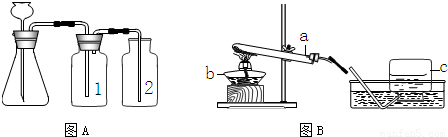
①玻璃仪器a、b、c的名称分别是______,______,______;
②小高制取二氧化碳气体,应选择图中的______装置(填字母),使用的药品是______和______,写出该反应的化学方程式______.
③小明要用A装置制取干燥的气体,则瓶(1)应盛放______(填序号)
A氢氧化钠溶液 B浓盐酸 C浓硫酸
④写出用B装置制取气体的一个化学方程式______△2KCl+3O2↑
【答案】分析:(1)①根据仪器的形状、结构、用途回答.
②根据实验室制二氧化碳的原理、药品的状态及反应条件、二氧化碳的性质回答.
③根据浓硫酸的吸水性回答.
④根据气体发生装置和收集装置的选择依据回答.
⑤根据装置气密性检查的原理回答.
(2)根据实验室制取二氧化碳的反应所使用的药品,液体药品未完全反应时,废液中则会含有液体药品中的溶质;
实验与设计:(2)酚酞试液遇酸性溶液或中性溶液均不变色,所以,不能使用酚酞试液检验废液是否呈酸性或中性;
(3)而紫色石蕊遇酸性、碱性或中性溶液会呈现不同的颜色,在检验溶液酸碱性时,可选择紫色石蕊进行实验;
拓展应用:(1)根据盐酸的性质及废液处理要求,可使用碳酸钙与废液中的盐酸继续反应以达到除去废液中盐酸而得到氯化钙溶液的目的;
(2)含有盐酸的废液如果直接倒入下水道会与铁质管道反应反应而损坏管道甚至造成水质污染.
解答:解:(1)①a是反应容器,也可给液体加热,是试管;b是加热的热源仪器,是酒精灯;c是收集气体的集气瓶.
故答案为:试管;酒精灯;集气瓶.
②实验室用大理石和稀盐酸反应制取二氧化碳的原理是:碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;使用的实际药品是大理石和稀盐酸;是固体与液体反应且不需要加热,故发生装置选A.
故答案为:A;大理石(或石灰石)、稀盐酸;CaCO3+2HCl=CaCl2+H2O+CO2↑.
③因浓硫酸有吸水性,可作气体干燥剂,要用A装置制取干燥的气体,则瓶①应盛放浓硫酸.
故选C
④B是加热固体制气体的装置,收集气体用排水法,则气体难溶于水或不易溶于水,符合条件的是氧气,制氧气可用加热氯酸钾和二氧化锰混合物的方法,故方程式为:2KClO3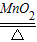 2KCl+3O2↑.
2KCl+3O2↑.
故答案为:2KClO3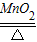 2KCl+3O2↑.
2KCl+3O2↑.
⑤检查装置的气密性一般是根据气压原理,向A装置中分别加水浸没集气瓶2中导管的末端和锥形瓶中长颈漏斗的末端,然后用热毛巾捂住洗气瓶1,若装置严密,则集气瓶2中导管口有气泡冒出,锥形瓶内液面下降,长颈漏斗管内水柱上升,否则出现相反现象.
故答案为:导管口没有气泡冒出;液面不下降,长颈漏斗管内水柱不上升(或长颈漏斗管内液面与锥形瓶中液面不形成液面差).
(2)实验室使用大理石或石灰石与稀盐酸反应制取二氧化碳,反应后的溶液除含有生成的氯化钙外,还可能含有过量的盐酸,因此,猜想废液中的溶质还可能含有HCl;
故答案为:HCl;
实验与设计:(2)酚酞试液只能遇碱性溶液变成红色,因此,使用酚酞试液不能检验废液中是否含有呈酸性的盐酸或中中性的氯化钙溶液;
故答案为:不能;酚酞遇盐酸也不变色,无法确定是否含有HCl;
(3)此色的石蕊试液遇酸变成红色,遇碱变成蓝色,而在中性溶液中仍呈紫色,因此,使用紫色石蕊试液可以检验废液中是否含有呈酸性的盐酸.
故答案为:紫色石蕊试液;溶液变红;
拓展应用:(1)废液中过量的盐酸可通过继续加入碳酸钙的方法而除去,把剩余的碳酸钙过滤除去即可使废液中只含有溶质氯化钙;
故答案为:CaCO3;
(2)由于废液中的盐酸可与金属铁等反应,因此若把废液直接倒入下水道,则会造成下水道的铁制管道被腐蚀,同时造成水质被污染;
故答案为:可能腐蚀铁制下水管道(或污染水质).
点评:气体发生装置的选择依据是药品的状态和反应的条件,气体收集装置的选择依据是气体的性质,了解气体制取的反应原理,明确药品的状态和反应条件,掌握气体的性质是解题的关键;实验室使用石灰石或大理石反应制取二氧化碳,其中盐酸的性质有:可以使酸碱指示剂石蕊变红,可与活泼金属置换出氢气,可与金属氧化物发生复分解反应,可与碱发生中和反应,可与碳酸盐反应放出二氧化碳.
②根据实验室制二氧化碳的原理、药品的状态及反应条件、二氧化碳的性质回答.
③根据浓硫酸的吸水性回答.
④根据气体发生装置和收集装置的选择依据回答.
⑤根据装置气密性检查的原理回答.
(2)根据实验室制取二氧化碳的反应所使用的药品,液体药品未完全反应时,废液中则会含有液体药品中的溶质;
实验与设计:(2)酚酞试液遇酸性溶液或中性溶液均不变色,所以,不能使用酚酞试液检验废液是否呈酸性或中性;
(3)而紫色石蕊遇酸性、碱性或中性溶液会呈现不同的颜色,在检验溶液酸碱性时,可选择紫色石蕊进行实验;
拓展应用:(1)根据盐酸的性质及废液处理要求,可使用碳酸钙与废液中的盐酸继续反应以达到除去废液中盐酸而得到氯化钙溶液的目的;
(2)含有盐酸的废液如果直接倒入下水道会与铁质管道反应反应而损坏管道甚至造成水质污染.
解答:解:(1)①a是反应容器,也可给液体加热,是试管;b是加热的热源仪器,是酒精灯;c是收集气体的集气瓶.
故答案为:试管;酒精灯;集气瓶.
②实验室用大理石和稀盐酸反应制取二氧化碳的原理是:碳酸钙与盐酸反应生成氯化钙、水、二氧化碳,方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;使用的实际药品是大理石和稀盐酸;是固体与液体反应且不需要加热,故发生装置选A.
故答案为:A;大理石(或石灰石)、稀盐酸;CaCO3+2HCl=CaCl2+H2O+CO2↑.
③因浓硫酸有吸水性,可作气体干燥剂,要用A装置制取干燥的气体,则瓶①应盛放浓硫酸.
故选C
④B是加热固体制气体的装置,收集气体用排水法,则气体难溶于水或不易溶于水,符合条件的是氧气,制氧气可用加热氯酸钾和二氧化锰混合物的方法,故方程式为:2KClO3
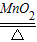 2KCl+3O2↑.
2KCl+3O2↑.故答案为:2KClO3
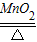 2KCl+3O2↑.
2KCl+3O2↑.⑤检查装置的气密性一般是根据气压原理,向A装置中分别加水浸没集气瓶2中导管的末端和锥形瓶中长颈漏斗的末端,然后用热毛巾捂住洗气瓶1,若装置严密,则集气瓶2中导管口有气泡冒出,锥形瓶内液面下降,长颈漏斗管内水柱上升,否则出现相反现象.
故答案为:导管口没有气泡冒出;液面不下降,长颈漏斗管内水柱不上升(或长颈漏斗管内液面与锥形瓶中液面不形成液面差).
(2)实验室使用大理石或石灰石与稀盐酸反应制取二氧化碳,反应后的溶液除含有生成的氯化钙外,还可能含有过量的盐酸,因此,猜想废液中的溶质还可能含有HCl;
故答案为:HCl;
实验与设计:(2)酚酞试液只能遇碱性溶液变成红色,因此,使用酚酞试液不能检验废液中是否含有呈酸性的盐酸或中中性的氯化钙溶液;
故答案为:不能;酚酞遇盐酸也不变色,无法确定是否含有HCl;
(3)此色的石蕊试液遇酸变成红色,遇碱变成蓝色,而在中性溶液中仍呈紫色,因此,使用紫色石蕊试液可以检验废液中是否含有呈酸性的盐酸.
故答案为:紫色石蕊试液;溶液变红;
拓展应用:(1)废液中过量的盐酸可通过继续加入碳酸钙的方法而除去,把剩余的碳酸钙过滤除去即可使废液中只含有溶质氯化钙;
故答案为:CaCO3;
(2)由于废液中的盐酸可与金属铁等反应,因此若把废液直接倒入下水道,则会造成下水道的铁制管道被腐蚀,同时造成水质被污染;
故答案为:可能腐蚀铁制下水管道(或污染水质).
点评:气体发生装置的选择依据是药品的状态和反应的条件,气体收集装置的选择依据是气体的性质,了解气体制取的反应原理,明确药品的状态和反应条件,掌握气体的性质是解题的关键;实验室使用石灰石或大理石反应制取二氧化碳,其中盐酸的性质有:可以使酸碱指示剂石蕊变红,可与活泼金属置换出氢气,可与金属氧化物发生复分解反应,可与碱发生中和反应,可与碳酸盐反应放出二氧化碳.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目