题目内容
海水蕴藏着丰富的化学资源,目前世界60%的镁是从海水中提取的.其主要流程如图所示.某校兴趣小组同学对从海水中提取金属镁的过程进行了有关探究.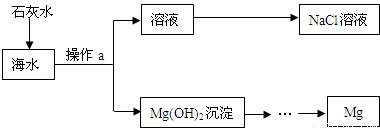
(1)在实验室进行操作a时需要的一种玻璃仪器是______;分离后的溶液(海水)中含有CaCl2等杂质,可向其中加入过量的______、______(填物质的化学式),以除去CaCl2制得较为纯净的NaCl溶液.
(2)兴趣小组同学取一定量的海水样品,分别加入NaOH溶液,进行实验,测得的实验数据如下表:
| 实验1 | 实验2 | 实验3 | |
| 海水样品质量/g | 100 | 100 | 100 |
| 加入NaOH溶液质量/g | 10 | 15 | 20 |
| 生成沉淀物的质量/g | 0.22 | 0.29 | 0.29 |
①海水样品中氯化镁的质量分数是多少?(计算结果精确到0.001)
②若从1t这种海水中可提取多少千克金属镁?
【答案】分析:(1)根据过滤的操作过程和使用的仪器回答前一空;根据碳酸钠、氯化钙、盐酸的化学性质回答后一空,除去氯化钙一般用沉淀法,常用碳酸钠,为除杂彻底,碳酸钠要过量,过量的碳酸钠又可用稀盐酸除去.
(2)①根据测得的实验数据分析哪组实验中海水中的氯化镁完全反应,100克海水中当加入15克氢氧化钠溶液时生成沉淀的质量不再增加,说明海水中的氯化镁完全反应最多生成氢氧化镁沉淀0.29克,然后按该组数据和反应方程式计算海水中氯化镁的质量;
②根据氯化镁或氢氧化镁中镁的质量分数计算.
解答:解:(1)过滤的操作过程中使用的仪器有铁架台、烧杯、漏斗、玻璃棒,后三种都是玻璃仪器;由于碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,故可在海水中先加入过量的碳酸钠溶液,使氯化钙完全转化为氯化钠,然后过滤除去碳酸钙,最后根据碳酸钠与盐酸反应生成氯化钠和、水、二氧化碳,再用适量的盐酸再除去过量的碳酸钠.
(2)①设100g海水中含有MgCl2 的质量为x
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 0.29
95:x=58:0.29
x=0.475 g
①海水样品中氯化镁的质量分数为: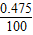 ×100%=0.475%
×100%=0.475%
②1000 kg×0.475%×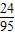 =1.2kg=1200g
=1.2kg=1200g
或 0.29 g×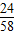 ×
×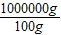 =1200g
=1200g
故答案为:
(1)烧杯或漏斗或玻璃棒;Na2CO3;适量的HCl;
(2)①0.475%;②1.2kg.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力,另外化学方程式的计算要注意格式和步骤.
(2)①根据测得的实验数据分析哪组实验中海水中的氯化镁完全反应,100克海水中当加入15克氢氧化钠溶液时生成沉淀的质量不再增加,说明海水中的氯化镁完全反应最多生成氢氧化镁沉淀0.29克,然后按该组数据和反应方程式计算海水中氯化镁的质量;
②根据氯化镁或氢氧化镁中镁的质量分数计算.
解答:解:(1)过滤的操作过程中使用的仪器有铁架台、烧杯、漏斗、玻璃棒,后三种都是玻璃仪器;由于碳酸钠能与氯化钙反应生成碳酸钙沉淀和氯化钠,故可在海水中先加入过量的碳酸钠溶液,使氯化钙完全转化为氯化钠,然后过滤除去碳酸钙,最后根据碳酸钠与盐酸反应生成氯化钠和、水、二氧化碳,再用适量的盐酸再除去过量的碳酸钠.
(2)①设100g海水中含有MgCl2 的质量为x
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58
x 0.29
95:x=58:0.29
x=0.475 g
①海水样品中氯化镁的质量分数为:
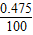 ×100%=0.475%
×100%=0.475% ②1000 kg×0.475%×
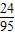 =1.2kg=1200g
=1.2kg=1200g 或 0.29 g×
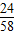 ×
×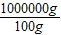 =1200g
=1200g故答案为:
(1)烧杯或漏斗或玻璃棒;Na2CO3;适量的HCl;
(2)①0.475%;②1.2kg.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力,另外化学方程式的计算要注意格式和步骤.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
海水蕴藏着丰富的化学资源,目前世界60%的镁是从海水中提取的.其主要流程如图所示.某校兴趣小组同学对从海水中提取金属镁的过程进行了有关探究.

(1)在实验室进行操作a时需要的一种玻璃仪器是 ;分离后的溶液(海水)中含有CaCl2等杂质,可向其中加入过量的 、 (填物质的化学式),以除去CaCl2制得较为纯净的NaCl溶液.
(2)兴趣小组同学取一定量的海水样品,分别加入NaOH溶液,进行实验,测得的实验数据如下表:
观察与分析上述数据,并计算
①海水样品中氯化镁的质量分数是多少?(计算结果精确到0.001)
②若从1t这种海水中可提取多少千克金属镁?

(1)在实验室进行操作a时需要的一种玻璃仪器是
(2)兴趣小组同学取一定量的海水样品,分别加入NaOH溶液,进行实验,测得的实验数据如下表:
| 实验1 | 实验2 | 实验3 | |
| 海水样品质量/g | 100 | 100 | 100 |
| 加入NaOH溶液质量/g | 10 | 15 | 20 |
| 生成沉淀物的质量/g | 0.22 | 0.29 | 0.29 |
①海水样品中氯化镁的质量分数是多少?(计算结果精确到0.001)
②若从1t这种海水中可提取多少千克金属镁?

 ),则可能的原因是(填字母) 。
),则可能的原因是(填字母) 。
 (3)若NaCl的产率偏低( ),则可能的原因是(填字母) 。
(3)若NaCl的产率偏低( ),则可能的原因是(填字母) 。