题目内容
【题目】小科发现暖水瓶中有一层淡黄色的水垢.据悉,该地区的水垢中除了碳酸钙外,无其它盐类.他想探究还有没有其它物质,于是他收集水垢后经低温烘干进行下列实验:

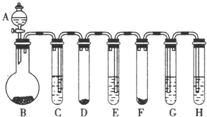
(1)取2.5g水垢按图甲中的A装置高温加热充分反应(已知CaCO3![]() CaO+CO2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g.
CaO+CO2↑),产生的气体依次通过B、C装置,实验后发现C装置中氢氧化钠溶液增加了0.88g.
①写出C装置中发现的化学反应方程式
②B装置中的浓硫酸是用来吸收反应中产生的水蒸气,这是利用了浓硫酸的 性.
③该水垢所含碳酸钙的质量分数为 .
(2)按图乙所示的方法来实验,结果发现澄清石灰水没有变浑浊,原因是 .
【答案】(1)CO2 +2NaOH═Na2CO3+H2O.吸水.80%
(2)浓盐酸具有挥发性,与氢氧化钙反应(或浓盐酸有挥发性,产生的沉淀被盐酸溶解).
【解析】(1)①氢氧化钠和二氧化碳反应能生成碳酸钠和水,反应的化学方程式为:CO2 +2NaOH═Na2CO3+H2O.
②浓硫酸能够用来吸收反应中产生的水蒸气,说明浓硫酸具有吸水性.
③C装置中氢氧化钠溶液增加了0.88g,说明碳酸钙分解生成了0.88g二氧化碳,
设碳酸钙的质量为X,
CaCO3![]() CaO+CO2↑
CaO+CO2↑
100 44
X 0.88g
![]() =
=![]()
X=2g,
该水垢所含碳酸钙的质量分数为:![]() ×100%=80%,
×100%=80%,
(2)浓盐酸具有挥发性,挥发出的氯化氢和二氧化碳进入石灰水中,氯化氢溶于水形成盐酸,盐酸能和氢氧化钙反应,也能够和生成的碳酸钙反应,所以不能产生沉淀.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目