题目内容
为了测定碳酸钠样品(内含有氯化钠)的纯度,现将10克样品加入重为5克的烧杯中,再往烧杯中加入40克水搅拌至固体完全溶解,再向烧杯中加入50克稀盐酸,恰好不再产生气泡,称得烧杯总质量为102.8克。
请完成下列计算:
(1)反应产生的气体的质量是多少?
(2)碳酸钠样品中碳酸钠的质量分数是多少?
(3)盐酸溶液中溶质的质量分数是多少?
(1)根据质量守恒定律,产生气体的质量为:10g+5g+40g+50g-102.8g=2.2g(1分)
(2)解:设碳酸钠样品中碳酸钠的质量为X
Na2CO3 + 2HCl = 2NaCl+ H2O + CO2 ↑
106 44
X 2.2g
106 : 44= X :2.2
X = 5.3)
样品中碳酸钠的质量分数为: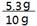 × 100% = 53% (1分)
× 100% = 53% (1分)
(3) 设盐酸溶液中溶质的质量分数为y
Na2CO3 + 2HCl = 2NaCl+ H2O + CO2 ↑
73 44
50g×y 2.2g
73 : 44 =(50g×y):2.2g
y =7.3%
解析

练习册系列答案
相关题目
如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表。
| | 气体发生装置内物质的总质量 |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
(l)反应中二氧化锰的作用是 。
(2)反应生成氧气的质量为 g(结果精确到0. 1 g,下同)。
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程。

 12CO2↑+ 10H2O↑+ 6X↑+ O2↑
12CO2↑+ 10H2O↑+ 6X↑+ O2↑