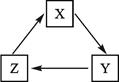
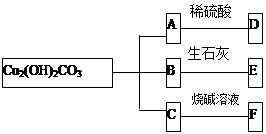题目内容
有一包白色粉末可能由NaCl、NaNO3、MgCl2、CuSO4、中的一种或多种物质组成。小明为了探究其成分,设计并完成了如下图所示的实验。
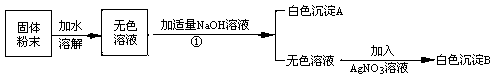
根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验 (填‘能’或‘不能’)确定原固体粉末中含有NaCl、NaNO3。

根据以上实验,回答:
操作①是
原固体粉末中一定没有的成分是
生成沉淀A的化学方程式是
根据上述实验 (填‘能’或‘不能’)确定原固体粉末中含有NaCl、NaNO3。
(1)过滤 (2)硫酸铜(3)2NaOH+MgCl2==Mg(OH)2↓+2NaCl (4)不能
试题分析:(1)根据图示可知:操作①将前面的混合物分离成白色沉淀和无色溶液两部分,即分离不溶性固体和液体。所以此操作为过滤。
(2)根据图示可知:固体粉末加水溶解后,可得到无色溶液,即溶液中不含有色物质。在题目所给的物质中,硫酸铜溶解于水会形成蓝色溶液,与题意不符。所以原固体粉末中一定不含硫酸铜。
(3)白色沉淀是由固体粉末溶解于水后与氢氧化钠反应生成的。根据题意可知,只有氯化镁可与氢氧化钠反应生成氢氧化镁沉淀和氯化钠。反应的化学方程式为:2NaOH+MgCl2==Mg(OH)2↓+2NaCl
(4)根据上述推测可知:固体中一定会存在氯化镁,所以无色溶液中含氯化镁与氢氧化钠反应生成的氯化钠。当再加入硝酸银时,可与其反应生成氯化银沉淀。符合题意产生白色沉淀B。因此无法确定原混合物中是否含氯化钠。硝酸钠在题目中的操作中不发生变化,无法确认是否存在。所以无法确定原固体粉末中是否含氯化钠和硝酸钠。

练习册系列答案
相关题目