题目内容
乙醇是以高粱、玉米、薯类等为原料,经发酵、蒸馏而制得,属于可再生能源.在汽油中加入适量乙醇作为汽油燃料,可节省石油资源,减少汽车尾气的污染.2001年4月2日国家技术监督局发布《车用乙醇汽油》国家标准,并于同年4月15日开始实施.乙醇(C2H5OH)完全燃烧时生成CO2和H20.如果氧气不充足,乙醇燃烧可能还生成CO.现用以上装置进行实验,确证乙醇燃烧产物中有CO、CO2和H20.请回答下列问题:
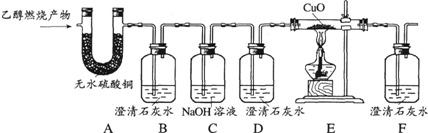
(1)能确证产物中有H20的现象是无水CuS04变蓝;能确证产物中有CO的现象是
(2)实验时,可观察到装置B中石灰水变浑浊,D中石灰水无变化.B装置的作用是
(3)若乙醇燃烧产物中CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,则参加化学反应的乙醇的质量为
分析:(1)白色的硫酸铜粉末是检验水的试剂,因其遇水变蓝,装置D中因为未遇到二氧化碳不变浑浊,一氧化碳与氧化铜反应会生成铜与二氧化碳;
(2)B装置检验C02的存在,C装置吸收CO2,D装置证明C02已被除尽;
(3)根据化学变化前后元素种类和质量不变,乙醇燃烧生成物二氧化碳、一氧化碳中碳元素质量总和即乙醇中碳元素质量,由乙醇中碳元素的质量计算出乙醇的质量,由乙醇中C、H元素质量比计算出H元素质量,由H元素质量计算生成水的质量.
(2)B装置检验C02的存在,C装置吸收CO2,D装置证明C02已被除尽;
(3)根据化学变化前后元素种类和质量不变,乙醇燃烧生成物二氧化碳、一氧化碳中碳元素质量总和即乙醇中碳元素质量,由乙醇中碳元素的质量计算出乙醇的质量,由乙醇中C、H元素质量比计算出H元素质量,由H元素质量计算生成水的质量.
解答:解:(1)一氧化碳它会和氧化铜反应生成铜并产生二氧化碳,为进一步证明是一氧化碳参与,故在反应后用澄清石灰水验证这一反应生成了二氧化碳;
(2)B装置是检验二氧化碳是否存在,C装置的作用是吸收乙醇燃烧产物中的CO2,故D装置在经过BC两个装置的情况下,进一步证明通入的气体中是否还有二氧化碳的存在;
(3)CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,
碳元素质量=25.2g×
=7.2g
参加反应的乙醇的质量=碳元素的质量÷
=7.2g÷
=13.8g;
乙醇中C、H元素质量比=24:6=4:1,则乙醇中H元素质量=
=1.8g
乙醇燃烧生成水的质量=1.8g ÷
×100%=16.2g
故答案为:
(1)装置E中黑色粉末变成亮红色;装置F中石灰水变浑浊;
(2)检验C02的存在;吸收CO2;证明C02已被除尽;
(3)13.8 g;16.2 g.
(2)B装置是检验二氧化碳是否存在,C装置的作用是吸收乙醇燃烧产物中的CO2,故D装置在经过BC两个装置的情况下,进一步证明通入的气体中是否还有二氧化碳的存在;
(3)CO和CO2的总质量为25.2g,其中碳元素与氧元素的质量比为2:5,
碳元素质量=25.2g×
| 2 |
| 2+5 |
参加反应的乙醇的质量=碳元素的质量÷
| 碳元素的相对原子质量×碳原子个数 |
| 乙醇的相对分子质量 |
| 12×2 |
| 46 |
乙醇中C、H元素质量比=24:6=4:1,则乙醇中H元素质量=
| 7.2g |
| 4 |
乙醇燃烧生成水的质量=1.8g ÷
| 2 |
| 18 |
故答案为:
(1)装置E中黑色粉末变成亮红色;装置F中石灰水变浑浊;
(2)检验C02的存在;吸收CO2;证明C02已被除尽;
(3)13.8 g;16.2 g.
点评:可燃物在氧气充足时完全燃烧,其中C元素生成二氧化碳、H元素生成水;在氧气不足时不完全燃烧,可燃物中的C元素就可能生成二氧化碳或一氧化碳.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

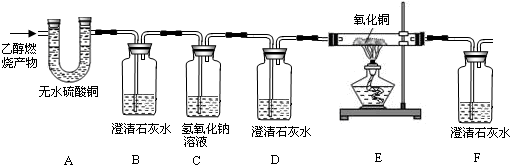
 )完全燃烧时生成
)完全燃烧时生成 。如果氧气不足,乙醇燃烧可生成多种物质。现用下图装置进行实验,确证乙醇燃烧产物中有CO、
。如果氧气不足,乙醇燃烧可生成多种物质。现用下图装置进行实验,确证乙醇燃烧产物中有CO、 和
和 。
。