题目内容
(2010?贵港)为了回收硝酸亚铁和硝酸银的混合溶液中的银,设计了如下的实验方案:
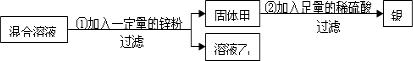
(1)若溶液乙为无色溶液,则固体甲一定有的物质是
(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是

(1)若溶液乙为无色溶液,则固体甲一定有的物质是
Ag、Fe
Ag、Fe
,可能有的物质是Zn
Zn
,步骤②中肯定发生的反应的化学方程式为Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(2)若溶液乙为浅绿色溶液,则溶液乙中溶质的组成可能是
Zn(NO3)2、Fe(NO3)2
Zn(NO3)2、Fe(NO3)2
或Zn(NO3)2、Fe(NO3)2、AgNO3
Zn(NO3)2、Fe(NO3)2、AgNO3
(填物质的名称或化学式).分析:根据溶液颜色特征,分析流程图中反应的发生情况,对所得固体或溶液组成成分进行分析.
解答:解:(1)溶液乙为无色溶液,可判断溶液乙中不含亚铁离子,则原溶液中的硝酸亚铁被全部置换,根据金属活动性,硝酸银中金属银先于铁被置换出来,因此,原溶液中的硝酸银、硝酸铁全部被置换,反应后所得固体中一定含有被置换出来的金属铁和银;如果加入的锌过量,则固体中含有锌;
故选Ag、Fe;Zn;
固体甲中一定含有铁、银,向其加入稀硫酸,则铁与稀硫酸反应,生成硫酸亚铁和氢气;
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)溶液乙为浅绿色,说明原溶液中的硝酸亚铁没有完全反应,则所加入金属锌量不足;根据盐溶液与金属反应的先后顺序可判断:所加入金属锌和硝酸银溶液完全反应后,继续和硝酸亚铁反应,由于溶液中含有硝酸亚铁,所以不能判断硝酸银溶液是否完全反应.则反应后溶液中所含溶质可能有:硝酸锌、硝酸亚铁或硝酸锌、硝酸亚铁、硝酸银.
故答案为:Zn(NO3)2、Fe(NO3)2;Zn(NO3)2、Fe(NO3)2、AgNO3.
故选Ag、Fe;Zn;
固体甲中一定含有铁、银,向其加入稀硫酸,则铁与稀硫酸反应,生成硫酸亚铁和氢气;
故答案为:Fe+H2SO4=FeSO4+H2↑;
(2)溶液乙为浅绿色,说明原溶液中的硝酸亚铁没有完全反应,则所加入金属锌量不足;根据盐溶液与金属反应的先后顺序可判断:所加入金属锌和硝酸银溶液完全反应后,继续和硝酸亚铁反应,由于溶液中含有硝酸亚铁,所以不能判断硝酸银溶液是否完全反应.则反应后溶液中所含溶质可能有:硝酸锌、硝酸亚铁或硝酸锌、硝酸亚铁、硝酸银.
故答案为:Zn(NO3)2、Fe(NO3)2;Zn(NO3)2、Fe(NO3)2、AgNO3.
点评:活泼金属与盐溶液反应时,会按金属活动性由弱到强的顺序逐一置换.

练习册系列答案
相关题目
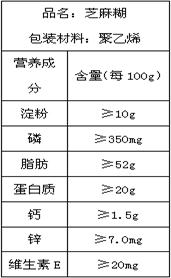 (2010?贵港)右表是某厂家生产的芝麻糊包装袋上的部分说明.
(2010?贵港)右表是某厂家生产的芝麻糊包装袋上的部分说明.