题目内容
【题目】用某金属颗粒与足量的稀盐酸反应,生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标示,单位:g)之间的关系如图,该金属颗粒可能是( )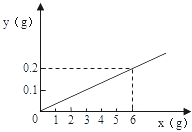
A.纯净的锌
B.含铜的锌
C.只含镁和铝的合金
D.含有不与酸反应杂质的铁
【答案】D
【解析】由图示可知,金属6g完全反应时生成氢气质量为0.2g,而6g锌完全反应生成氢气质量小于0.2g,6g镁或铝完全反应生成氢气质量都大于0.6g,6g铁完全反应生成氢气质量大于0.2g,由此可知D符合题意;
故答案为:D。根据方程式计算分析,先将6g当成某纯金属,计算出与酸反应和成氢气的质量,与所给0.6对比,比0.6大时则要混合产生氢气小于0.6或不产生氢气的金属,比0.6小时则要混合产生比0.6大的金属。

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目