题目内容
【题目】工厂产生的废液中含有硫酸铜、硫酸亚铁、硫酸锌、硫酸。为节能减排,回收硫酸锌及有关金属,设计如图部分流程。


(1)固体A的成分是_____;步骤Ⅱ中滤液C中所含的溶质有_____。
(2)写出步骤Ⅱ中生成气体的化学方程式_____,生成铁的化学方程式是_____。
【答案】铜、铁、锌 硫酸亚铁、硫酸锌、硫酸 Fe+H2SO4═FeSO4+H2↑,Zn+H2SO4═ZnSO4+H2↑ Zn+FeSO4═ZnSO4+Fe
【解析】
(1)废液中加入过量的锌,锌和硫酸铜反应生成硫酸锌和铜,和硫酸亚铁反应生成硫酸锌和铁,和硫酸反应生成硫酸锌和氢气,因此固体A的成分是铜、铁、锌(过量的);
步骤Ⅱ中,稀硫酸和铁反应生成硫酸亚铁和氢气,和锌反应生成硫酸锌和氢气,因此滤液C中所含的溶质有硫酸亚铁、硫酸锌、硫酸(过量的)。
(2)步骤Ⅱ中稀硫酸和铁反应生成硫酸亚铁和氢气的化学方程式:Fe+H2SO4═FeSO4+H2↑,稀硫酸和锌反应生成硫酸锌和氢气的化学方程式:Zn+H2SO4═ZnSO4+H2↑;
锌和硫酸亚铁反应生成硫酸锌和铁的化学方程式是:Zn+FeSO4═ZnSO4+Fe。

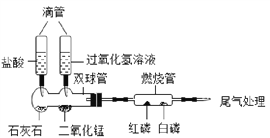
【题目】现有一包黑色固体粉末,可能含有炭粉、CuO、Fe3O4中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(1)提出问题:该黑色固体粉末成分是什么?
(2)作出猜想:
猜想一:混合固体是炭粉、CuO
猜想二:混合固体是炭粉、Fe3O4
猜想三:混合固体是_____(物质写不去不给分)
猜想四:混合固体是炭粉、CuO、Fe3O4
(3)查阅资料:Fe3O4为黑色粉末,能与盐酸反应,含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色,Fe(OH)2是一种白色沉淀。
(4)实验探究:取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量滤液A于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体物质一定没有_____ |
步骤二:又取一定量的滤液A于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液A中一定含有的物质是_____ |
步骤三:再取一定量的滤液A于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色 | 滤液A中还一定含有的物质是_____ |
(5)讨论交流:
①通过以上实验,猜想_____成立。
②写出Fe3O4与盐酸反应的化学方程式:_____。
③四氧化三铁作为铁的一种氧化物,在高温下还能被单质铝还原,同时生成一种稳定的氧化物,请你写出该反应的化学方程式:_____。
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式______ ,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
(实验用品)pH试纸、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液总溶质的可能组成成分。
猜想一:硫酸钠
猜想二:硫酸钠、碳酸氢钠
猜想三:硫酸钠、硫酸
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成如表实验现象中的空格。
实验方案 | A | B | C |
实验操作 |
|
|
|
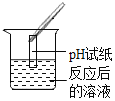
实验现象 | 无明显现象 | 产生白色沉淀 | 试纸变色,对照标准比色卡, pH ______ 7 |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)
(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显错误是:______。
(2)小明同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:______。
(拓展应用)
(3)小明同学用______代替BaCl2溶液,同样得出猜想三是正确的。