题目内容
实验设计,自然界矿物中一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的硫酸钡可供医疗等方面应用,课外活动小组同学,用重晶石矿焦炭为原料,制取纯净硫酸钡.(设矿物中杂质不与焦炭反应,也不溶于水)部分流程如下: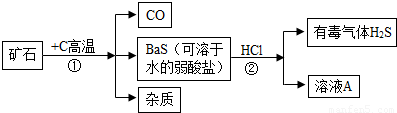
按要求填空
(1)在步骤①中,哪些元素的化合价升高了,哪些元素的化合价降低了?______.
(2)写出步骤②中溶液A的溶质的化学式______.
(3)写出利用A溶液制取BaSO4的化学方程式:______.
(4)有同学指出,上述步骤②产生有毒气体H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获纯净BaSO4.请写有关化学方程式:______.
【答案】分析:(1)分析该步骤中各物质所发生的变化,确定反应前后各物质中元素化合价,找出元素化合价发生改变的元素,可得到元素化合价升降的结论;
(2)根据弱酸盐能与强酸盐酸发生复分解反应,利用复分解反应相互交换成分的特点,可判断溶液A中的溶质;
(3)由溶液A中溶质为氯化钡的结,利用组成的差别,可选择含硫酸根离子的可溶性物质来反应生成硫酸钡;
(4)根据盐类物质的性质特点,可溶于水的硫化钡与可溶性硫酸盐发生复分解反应而生成硫酸钡和另外一种盐,满足了不产生硫化氢气体污染物的要求,按此思路确定反应并写出反应的化学方程式.
解答:解:(1)杂质不参与反应,因此不考虑杂质中的元素;而反应前BaSO4与C中Ba、S、O、C元素的化合价分别为+2、+6、-2、0,反应后BaS、CO中Ba、S、O、C元素的化合价分别为+2、-2、-2、+2,因此可判断碳元素化合价由0升高至+2,而硫元素的化合价由+6降低至-2,故答案为:碳元素化合价升高,硫元素化合价降低;
(2)硫化钡与盐酸反应生成硫化氢气体,可判断反应的化学方程式为BaS+2HCl=BaCl2+H2S↑,因此该步反应中所得溶液A中溶质为氯化钡,其化学式为BaCl2,故答案为:BaCl2;
(3)根据复分解反应的特点,若有硫酸钡生成,应选择一种含有硫酸根离子的溶液和氯化钡溶液反应,则选择稀硫酸、硫酸钠溶液或者硫酸钾溶液,
故答案为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
(4)利用硫化钡这种盐与可溶解性硫酸盐能生成硫酸钡和另一种盐,既可避免与盐酸反应放出有毒气体硫化氢又可直接转化为硫酸钡,因此可采取在步骤②中加入硫酸钠,反应后过滤并洗涤除去附在固体表面的溶液,得到较为纯净的硫酸钡,反应的化学方程式为,故答案为:BaS+Na2SO4=BaSO4↓+Na2S.
点评:本题难度较大,主要考查了酸的有关的化学性质,学生应能利用复分解反应及物质组成上的差别来选择试剂,并判断发生的化学反应来解答本题.
(2)根据弱酸盐能与强酸盐酸发生复分解反应,利用复分解反应相互交换成分的特点,可判断溶液A中的溶质;
(3)由溶液A中溶质为氯化钡的结,利用组成的差别,可选择含硫酸根离子的可溶性物质来反应生成硫酸钡;
(4)根据盐类物质的性质特点,可溶于水的硫化钡与可溶性硫酸盐发生复分解反应而生成硫酸钡和另外一种盐,满足了不产生硫化氢气体污染物的要求,按此思路确定反应并写出反应的化学方程式.
解答:解:(1)杂质不参与反应,因此不考虑杂质中的元素;而反应前BaSO4与C中Ba、S、O、C元素的化合价分别为+2、+6、-2、0,反应后BaS、CO中Ba、S、O、C元素的化合价分别为+2、-2、-2、+2,因此可判断碳元素化合价由0升高至+2,而硫元素的化合价由+6降低至-2,故答案为:碳元素化合价升高,硫元素化合价降低;
(2)硫化钡与盐酸反应生成硫化氢气体,可判断反应的化学方程式为BaS+2HCl=BaCl2+H2S↑,因此该步反应中所得溶液A中溶质为氯化钡,其化学式为BaCl2,故答案为:BaCl2;
(3)根据复分解反应的特点,若有硫酸钡生成,应选择一种含有硫酸根离子的溶液和氯化钡溶液反应,则选择稀硫酸、硫酸钠溶液或者硫酸钾溶液,
故答案为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
(4)利用硫化钡这种盐与可溶解性硫酸盐能生成硫酸钡和另一种盐,既可避免与盐酸反应放出有毒气体硫化氢又可直接转化为硫酸钡,因此可采取在步骤②中加入硫酸钠,反应后过滤并洗涤除去附在固体表面的溶液,得到较为纯净的硫酸钡,反应的化学方程式为,故答案为:BaS+Na2SO4=BaSO4↓+Na2S.
点评:本题难度较大,主要考查了酸的有关的化学性质,学生应能利用复分解反应及物质组成上的差别来选择试剂,并判断发生的化学反应来解答本题.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
