题目内容
(2006?泰安)小明在“探究盐酸和氢氧化钙能否发生化学反应”时,设计了如图所示的对照实验: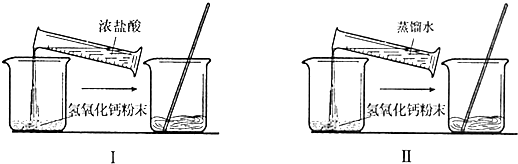
他设想在室温下,先取少量氢氧化钙粉末分别放入两只烧杯中,在Ⅱ烧杯中加入一定量的蒸馏水,在I烧杯中加入含等量蒸馏水的浓盐酸,充分搅拌,一段时间后,观察现象.
根据上述情况,请回答以下问题:
(1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中
(2)设计对照实验Ⅱ的目的是
(3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生化学反应:
(4)写出该反应的化学方程式

他设想在室温下,先取少量氢氧化钙粉末分别放入两只烧杯中,在Ⅱ烧杯中加入一定量的蒸馏水,在I烧杯中加入含等量蒸馏水的浓盐酸,充分搅拌,一段时间后,观察现象.
根据上述情况,请回答以下问题:
(1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中
氢氧化钙粉末的质量
氢氧化钙粉末的质量
完全相同.预测通过观察实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小)
实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小)
的现象,说明盐酸和氢氧化钙发生了化学反应;(2)设计对照实验Ⅱ的目的是
排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应
排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应
;(3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生化学反应:
在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应
在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应
;(4)写出该反应的化学方程式
Ca(OH)2+2HCl=CaCl2+2H20
Ca(OH)2+2HCl=CaCl2+2H20
.分析:(1)依据氢氧化钙的溶解性是微溶于水,所以放入水中一般会形成浑浊的溶液,来确定盐酸与氢氧化钙的反应.
(2)根据对照的目的分析,排除水的溶解可能性.
(3)借助中和反应发生时溶液的pH的变化情况,借助指示剂判断设计即可.
(4)中和反应的产物是盐和水,氢氧化钙与盐酸的反应也不例外.
(2)根据对照的目的分析,排除水的溶解可能性.
(3)借助中和反应发生时溶液的pH的变化情况,借助指示剂判断设计即可.
(4)中和反应的产物是盐和水,氢氧化钙与盐酸的反应也不例外.
解答:解:(1)依据氢氧化钙的溶解性是微溶于水,所以放入水中一般会形成浑浊的溶液,通过此现象来确定盐酸与氢氧化钙的反应,所以对照试验的固体的量必须相同,否则依据是否浑浊来分析反应的发生就没有意义了.
(2)因为在I烧杯中加入含等量蒸馏水的浓盐酸,根据对照的目的分析,排除蒸馏水的溶解可能性,才能说明盐酸与氢氧化钙的反应.
(3)借助中和反应发生时溶液的pH的变化情况,在碱的溶液中滴加酚酞,溶液变红加酸能使红色消失,则说明酸与碱能够发生反应.
(4)中和反应的产物是盐和水,氢氧化钙与盐酸的反应会生成氯化钙与水.
故答案为:(1)氢氧化钙粉末的质量;实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小).
(2)排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应.
(3)在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应.
(4)Ca(OH)2+2HCl=CaCl2+2H20
(2)因为在I烧杯中加入含等量蒸馏水的浓盐酸,根据对照的目的分析,排除蒸馏水的溶解可能性,才能说明盐酸与氢氧化钙的反应.
(3)借助中和反应发生时溶液的pH的变化情况,在碱的溶液中滴加酚酞,溶液变红加酸能使红色消失,则说明酸与碱能够发生反应.
(4)中和反应的产物是盐和水,氢氧化钙与盐酸的反应会生成氯化钙与水.
故答案为:(1)氢氧化钙粉末的质量;实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小).
(2)排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应.
(3)在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液,浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明盐酸与氢氧化钙能够发生化学反应.
(4)Ca(OH)2+2HCl=CaCl2+2H20
点评:此题是一道实验的设计题,解题的关键是找到对照实验的目的,依据酸碱中和反应的特性进行分析即可.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目