题目内容
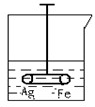
如图所示,烧杯中质量相等的铁圈和银圈用一根绝缘细丝相连,再两者之间,同样用一根绝缘细丝吊住,并使其在水中保持平衡,然后小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察铁圈、银圈的现象分别为______.试写出有关的化学方程式______.
【答案】分析:本题可利用金属活动性顺序结合反应时质量的变化解决,铁银铜三者的活动性顺序是铁>铜>银,所以铁可以置换出铜,但银不能置换出铜,铁与硫酸铜反应时一个铁原子正好置换出一个铜原子,依据其原子量可对质量的改变进行判断,从而得到结论.
解答:解:铁的金属活动性比铜强,故铁圈能与硫酸铜溶液反应生成硫酸亚铁和铜,反应时一个铁原子正好置换出一个铜原子,依据其原子量可对质量的改变可知,铁圈的质量增加;银的活动性比铜弱,不与硫酸铜溶液反应,故银圈的质量不变;所以铁圈向下倾斜.
故答案为:铁圈向下倾斜,Fe+CuSO4=FeSO4+Cu
点评:解答本题的关键是根据金属的活动性顺序多金属与酸反应的过程进行判断,并结合质量变化关系判断铁圈和银圈的质量变化情况.
解答:解:铁的金属活动性比铜强,故铁圈能与硫酸铜溶液反应生成硫酸亚铁和铜,反应时一个铁原子正好置换出一个铜原子,依据其原子量可对质量的改变可知,铁圈的质量增加;银的活动性比铜弱,不与硫酸铜溶液反应,故银圈的质量不变;所以铁圈向下倾斜.
故答案为:铁圈向下倾斜,Fe+CuSO4=FeSO4+Cu
点评:解答本题的关键是根据金属的活动性顺序多金属与酸反应的过程进行判断,并结合质量变化关系判断铁圈和银圈的质量变化情况.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 23、如图所示,烧杯中质量相等的铁圈和银圈用一根绝缘细丝相连,再两者之间,同样用一根绝缘细丝吊住,并使其在水中保持平衡,然后小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察铁圈、银圈的现象分别为
23、如图所示,烧杯中质量相等的铁圈和银圈用一根绝缘细丝相连,再两者之间,同样用一根绝缘细丝吊住,并使其在水中保持平衡,然后小心地从烧杯中央滴入CuSO4溶液,反应一段时间后,观察铁圈、银圈的现象分别为 如图所示,烧杯中质量相等的铁圈和银圈用一根绝缘细丝相连,在两者之间,并用一根绝缘细丝吊住,并使其在水中保持平衡,然后小心地向烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象为
如图所示,烧杯中质量相等的铁圈和银圈用一根绝缘细丝相连,在两者之间,并用一根绝缘细丝吊住,并使其在水中保持平衡,然后小心地向烧杯中央滴入CuSO4溶液,反应一段时间后,观察到的现象为