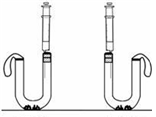
题目内容
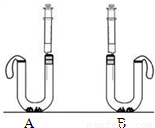
 小娜同学发现厨房中有两瓶无标签的白色粉末,妈妈告诉她是苏打和小苏打.为了鉴别这两瓶白色粉末,小娜各取了一小包并将它们编号为A、B,然后进行实验探究.
小娜同学发现厨房中有两瓶无标签的白色粉末,妈妈告诉她是苏打和小苏打.为了鉴别这两瓶白色粉末,小娜各取了一小包并将它们编号为A、B,然后进行实验探究.【查阅资料】苏打,学名为碳酸钠,20℃时溶解度为21.6g,其水溶液呈碱性…
小苏打.学名为碳酸氢钠,20℃时溶解度为9.8g,其水溶液的碱性比碳酸钠溶液的弱…
【实验探究】根据以上信息及学过的知识,小娜进行了以下的实验:
(1)20℃时,将A、B两种物质各6g分别加入到50g蒸馏水中,有白色固体剩余的是
碳酸氢钠
碳酸氢钠
;(2)用pH试纸测得A的溶液pH=10,B的溶液pH=8,则A粉末是
碳酸钠
碳酸钠
;(3)小娜通过计算发现,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应,
碳酸氢钠
碳酸氢钠
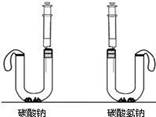
产生的二氧化碳更多,于是设计了下面的实验方案.在U型管中分别加入等质量A、B两种固体,在两支注射器中分别吸入足量稀盐酸,并注入U型管中.请写出碳酸氢钠与稀盐酸反应的化学方程式:NaHCO3+HCl=NaCl+CO2↑+H2O
NaHCO3+HCl=NaCl+CO2↑+H2O
. 实验需要观察的现象是最终气球膨胀的大小
最终气球膨胀的大小
.【反思提高】
(4)小娜想利用上述实验方案进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,请从设计方法的角度说明一下是否合理
不合理;所用固体质量相等,但所用盐酸没有说明体积相同、质量分数相同
不合理;所用固体质量相等,但所用盐酸没有说明体积相同、质量分数相同
.分析:(1)根据题意:20℃时,碳酸钠、碳酸氢钠的溶解度分析解答;
(2)根据题意:碳酸氢钠的水溶液的碱性比碳酸钠溶液的弱;
(3)根据方程式分析等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应生成二氧化多少,并通过实验证明;
(4)要进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,不仅所用固体质量相等,所用盐酸体积相同、质量分数也要相同.
(2)根据题意:碳酸氢钠的水溶液的碱性比碳酸钠溶液的弱;
(3)根据方程式分析等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应生成二氧化多少,并通过实验证明;
(4)要进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,不仅所用固体质量相等,所用盐酸体积相同、质量分数也要相同.
解答:解:
(1)从题目资料可知:0℃时碳酸氢钠溶解度是9.8克,碳酸钠的溶解度是21.6克;20℃时,在50克水中加入6克该白色粉末,由碳酸氢钠的溶解度可知50克水中最多溶解4.9克碳酸氢钠,所以白色固体剩余,没有完全溶解的应该是碳酸氢钠;
(2)根据题意:碳酸氢钠的水溶液的碱性比碳酸钠溶液的弱;A的溶液pH=10,B的溶液pH=8,A的碱性强,所以A是碳酸钠;
(3)因酸足量,则碳酸钠、碳酸氢钠完全参加反应;
Na2CO3+2HCl═2NaCl+CO2↑+H20,
106 44
NaHCO3+2HCl═2NaCl+CO2↑+H20,
84 44
由反应的化学方程式物质间的质量关系可知:106克碳酸钠可反应生成44克二氧化碳,而84克碳酸氢钠可反应生成44克二氧化碳,所以等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应,碳酸氢钠生成的二氧化碳质量更多;实验需要观察的现象是:最终气球膨胀的大小;
(4)要进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,不仅所用固体质量相等,所用盐酸体积相同、质量分数也要相同;所以利用上述实验方案进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢是不合理的;
故答案为:
(1)碳酸氢钠;
(2)碳酸钠;
(3)碳酸氢钠; NaHCO3+HCl=NaCl+CO2↑+H2O;最终气球膨胀的大小;
(4)不合理;所用固体质量相等,但所用盐酸没有说明体积相同、质量分数相同.
(1)从题目资料可知:0℃时碳酸氢钠溶解度是9.8克,碳酸钠的溶解度是21.6克;20℃时,在50克水中加入6克该白色粉末,由碳酸氢钠的溶解度可知50克水中最多溶解4.9克碳酸氢钠,所以白色固体剩余,没有完全溶解的应该是碳酸氢钠;
(2)根据题意:碳酸氢钠的水溶液的碱性比碳酸钠溶液的弱;A的溶液pH=10,B的溶液pH=8,A的碱性强,所以A是碳酸钠;
(3)因酸足量,则碳酸钠、碳酸氢钠完全参加反应;
Na2CO3+2HCl═2NaCl+CO2↑+H20,
106 44
NaHCO3+2HCl═2NaCl+CO2↑+H20,
84 44
由反应的化学方程式物质间的质量关系可知:106克碳酸钠可反应生成44克二氧化碳,而84克碳酸氢钠可反应生成44克二氧化碳,所以等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应,碳酸氢钠生成的二氧化碳质量更多;实验需要观察的现象是:最终气球膨胀的大小;
(4)要进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,不仅所用固体质量相等,所用盐酸体积相同、质量分数也要相同;所以利用上述实验方案进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢是不合理的;
故答案为:
(1)碳酸氢钠;
(2)碳酸钠;
(3)碳酸氢钠; NaHCO3+HCl=NaCl+CO2↑+H2O;最终气球膨胀的大小;
(4)不合理;所用固体质量相等,但所用盐酸没有说明体积相同、质量分数相同.
点评:本题考查学生根据物质的性质进行物质的鉴别,解答时应注意利用物质性质的差异来鉴别物质,将反应、现象、计算相结合来分析解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 (3)小娜通过计算发现,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应, 产生的二氧化碳更多,于是设计了下面的实验方案.在U型管中分别加入等质量A、B两种固体,在两支注射器中分别吸入足量稀盐酸,并注入U型管中.请写出碳酸氢钠与稀盐酸反应的化学方程式: 。 实验需要观察的现象是 。
(3)小娜通过计算发现,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应, 产生的二氧化碳更多,于是设计了下面的实验方案.在U型管中分别加入等质量A、B两种固体,在两支注射器中分别吸入足量稀盐酸,并注入U型管中.请写出碳酸氢钠与稀盐酸反应的化学方程式: 。 实验需要观察的现象是 。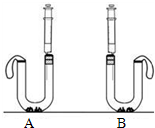 小娜同学发现厨房中有两瓶无标签的白色粉末,妈妈告诉她是苏打和小苏打.为了鉴别这两瓶白色粉末,小娜各取了一小包并将它们编号为A、B,然后进行实验探究.
小娜同学发现厨房中有两瓶无标签的白色粉末,妈妈告诉她是苏打和小苏打.为了鉴别这两瓶白色粉末,小娜各取了一小包并将它们编号为A、B,然后进行实验探究.