题目内容
【题目】为了测定某碳酸氢钠纯度(含有少量氯化钠),某学生设计了图13装置:称取1.5g此样品于图13的试管中,滴加稀盐酸至不再产生气泡为止,观察到量气管装有油层的液面从400.0ml降到70.1ml。
【标况下 ![]() (CO2)≈2.0g/L 反应的化学方程式为:NaHCO3+HClNaCl+H2O+CO2↑】
(CO2)≈2.0g/L 反应的化学方程式为:NaHCO3+HClNaCl+H2O+CO2↑】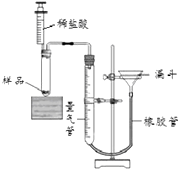
(1)反应结束时,收集到CO2质量。
(2)求该样品中NaHCO3的质量分数。
【答案】
(1)解:反应结束时,收集到CO2的体积为400.0mL70.0mL=330.0mL=0.33L,质量为:0.33L×2.0g/L=0.66g
(2)解:设碳酸氢钠的质量为 ![]() ,
,
NaHCO3+HCl═NaCl+H2O+ | CO2↑ |
84 | 44 |
x | 0.66g |
![]() ,
, ![]() =1.26g
=1.26g
该样品中NaHCO3的质量分数为 ![]() 。
。
答:该样品中NaHCO3的质量分数为84.0%。
【解析】本题是利用化学反应中一种物质的质量求另一种物质的质量,根据化学方程式计算即可。
故答案为:解:反应结束时,收集到CO2的体积为400.0mL70.0mL=330.0mL=0.33L,质量为:0.33L×2.0g/L=0.66g;
解:设碳酸氢钠的质量为 x ,
NaHCO3+HCl═NaCl+H2O+ | CO2↑ |
84 | 44 |
x | 0.66g |
![]() ,
, ![]() =1.26g
=1.26g
该样品中NaHCO3的质量分数为 ![]() 。
。
答:该样品中NaHCO3的质量分数为84.0%。
在化学反应中,参加反应的物质质量之比等于相对分子质量乘以化学计量数之比。

练习册系列答案
相关题目