题目内容
【题目】如图是盐酸的标签,回答下列问题:

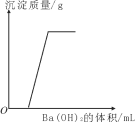
(1)用10mL该浓盐酸可配制成3.7%的稀盐酸多少克?_____
(2)稀释此溶液时,如果量取浓盐酸读数时仰视,将造成什么后果?_____
(3)稀释后的盐酸可用于除铁锈,写出反应的化学方程式_____。
【答案】118g 稀溶液质量分数偏大 Fe2O3+6HCl=2FeCl3+3H2O
【解析】
(1)根据已有的知识进行分析,稀释前后溶质质量不变。
(2)量取浓盐酸读数时仰视,会使实际量取的液体体积比要量取的液体体积偏大。
(3)根据铁锈的成分以及化学方程式的写法来分析。
(1)设配成盐酸的质量为x,1.18g/cm3=1.18g/mL,则有1.18g/mL×10mL×37%=3.7%x,解得x=118g,故填:118g。
(2)若量取浓盐酸读数时仰视,会使实际量取的液体体积比要量取的液体体积偏大,配制的溶液溶质的质量分数偏大;故填:稀溶液质量分数偏大。
(3)铁锈的主要成分是氧化铁,氧化铁和稀盐酸反应能生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;故填:Fe2O3+6HCl═2FeCl3+3H2O。

【题目】我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法。
(1)实验室制取气体时,确定发生装置需要考虑的两种因素有_______(填序号)。
A 反应物的状态 B 气体的密度
C 反应的条件 D 气体的溶解性
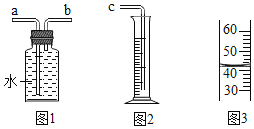
(2)实验室部分装置如图(A﹣F)所示,请回答:
(提示:装置C的多孔隔板,可以放置颗粒大小比孔径大的固体)
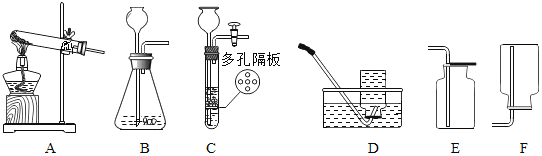
下表是初中几种常见气体的实验室制法,请你在横线上的空白处填上答案。
反应物 | 制取气体 | 发生装置(填字母) | 收集装置(填字母) |
大理石和稀盐酸 | CO2 | B或____ | _____ |
锌粒和稀硫酸 | H2 | B | D或 ____ |
高锰酸钾 | O2 | ___ | E或D |
(3)实验室常用高锰酸钾来制取氧气,其化学方程式为_____________ ;
(4)小颖同学在探究二氧化碳性质时,将二氧化碳气体通入紫色石蕊溶液中,石蕊溶液很快变红色,原因是_____________。
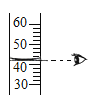
(5)若使用图1装置收集氧气,气体应从__________(填“a”或“b”)端通入。若通过连接图1和图2装置来测量氧气的体积,应将图2装置的c端与图1装置的__________(填“a”或“b”)端相连。一段时间后量筒内的凹液面如图3所示,则集得氧气的体积是__________mL。