题目内容
【题目】质量守恒定律的发现,使得化学科学由定性研究走向定量研究,促进了化学科学的发展。
(1)一定质量的镁条在空气中完全燃烧后,生成的固体质量______镁条的质量(填“<”、“>”或“=”),这与质量守恒定律______(填“矛盾”或“不矛盾”)。
(2)现有化学反应A+3B=C+2D,已知A为ag,B为bg,恰好完全反应后生成D为dg,则生成C的质量为______g。
(3)某纯净物X在氧气中燃烧的化学方程式为2X+5O2![]() 4CO2+2H2O,则X的化学式为_________。
4CO2+2H2O,则X的化学式为_________。
(4)4.6g某化合物在空气中完全燃烧,得到8.8g二氧化碳和5.4g水,则该化合物的组成元素是_______(填元素名称)。
【答案】> 不矛盾 ![]()
![]() 碳元素、氧元素和氢元素
碳元素、氧元素和氢元素
【解析】
根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和。
(1)一定质量的镁条在空气中完全燃烧生成氧化镁,氧化镁的质量是镁元素的质量和氧元素的质量和,故生成的固体质量>镁条的质量,氧气的质量和镁的质量和等于生成的氧化镁的质量,故这与质量守恒定律不矛盾。
(2)化学反应A+3B=C+2D,已知A为ag,B为bg,由质量守恒定律可知,反应前各物质的质量总和等于反应后生成各物质的质量总和,恰好完全反应后生成D为dg,则生成C的质量为![]() g。
g。
(3)某纯净物X在氧气中燃烧的化学方程式为2X+5O2![]() 4CO2+2H2O,根据质量守恒定律,在化学反应中,反应前后原子的种类没有改变,数目没有增减,反应前有10个氧原子,反应后有4个碳原子,10个氧原子,4个氢原子,则X的化学式为
4CO2+2H2O,根据质量守恒定律,在化学反应中,反应前后原子的种类没有改变,数目没有增减,反应前有10个氧原子,反应后有4个碳原子,10个氧原子,4个氢原子,则X的化学式为![]() 。
。
(4)化合物在空气中完全燃烧,生成二氧化碳和水,则化合物中含有碳元素、氢元素,8.8g二氧化碳中碳元素的质量为![]() ,5.4g水中含氢元素的质量为
,5.4g水中含氢元素的质量为![]() ,
,![]() ,则化合物中存在氧元素,
,则化合物中存在氧元素,
故该化合物的组成元素是碳元素、氧元素和氢元素。

 名校课堂系列答案
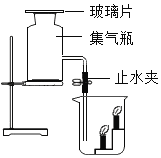
名校课堂系列答案【题目】实验室常用的气体发生装置如下:

(1)装置A的名称__________,用该装置制取二氧化碳气体的化学方程式是___________。
(2)搭建B装置时,酒精灯应在固定试管之________(填“前”或“后”)放置。
(3)用粉末状二氧化锰和3%的过氧化氢溶液混合制取氧气的化学方程式_______,用C装置进行该反应时,为较好地控制氧气的产生速率,应采取的操作是____________。
(4)在研究实验室制取二氧化碳的过程中,进行了如下实验:
实验编号 | 甲 | 乙 | 丙 | 丁 |
大理石 | m g,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
盐酸(过量) | w g,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
①研究盐酸浓度大小对反应速率的影响,可选择实验甲与实验________进行对比实验(选填实验编号)。
②上述实验说明影响反应速率的因素有浓度、_________。
③实验丁最后所得溶液的质量小于实验甲最后所得溶液的质量,其原因是_________。
【题目】酒精灯是实验室中常用的加热仪器,某小组同学对酒精灯火焰温度进行如下探究:
(1)定性研究:甲同学取一根火柴梗,拿住一端迅速平放入酒精灯火焰中,约1~2 s后取出,观察到位于外焰的部分明显炭化。由上述现象得出的结论是外焰温度最高,原因可能是_____________________________。
(2)定量研究:乙、丙同学在老师的指导下,分别利用高温传感器测得酒精灯各层火焰的平均温度如下表所示:
火焰 | 平均温度/℃ | |
乙 | 丙 | |
焰心 | 432 | 598 |
内焰 | 666 | 783 |
外焰 | 520 | 667 |
①由上表得出结论:___________(填“外焰”“内焰”或“焰心”)温度最高,产生与上述(1)不同结论的可能原因是__________________。
②结合定量研究结论,下列图示中的加热方法(试管夹未画出)中最合理的是____________(填字母)。
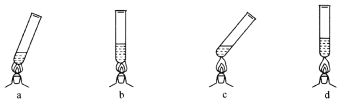
(3)交流反思:不仅酒精灯的各层火焰温度不同,而且相同火焰层温度也有差异。造成乙、丙两同学所测相同火焰层温度有差异的原因可能是(写出两点即可):
①_____________________________;
②_____________________________。