��Ŀ����
����Ŀ��Ϊ��֤̼���Ƶ����ʣ�ͬѧ�ǽ���������ʵ�顣
������ͼAװ�ý�������ʵ�飺
ʵ��װ�� | ʵ�鲽�� | ʵ�������ʽ |
| �� ������ƿ�ڵ���һ������̼������Һ�����μӷ�̪�� | ��Һ��_______ɫ�� |
�� ��ͼA��ʾ����װ�ã���ע����1�ij���ͷ����ƿ��Һ���£���ȡ����̼������Һ�� | ע����1��Һ�����ǣ�д����Ӧ�Ļ�ѧ����ʽ_______�� | |
�� ��ע����2�е�ϡ������ȫע������ƿ�С� | �����������У��ܹ۲쵽��ʵ��������_______�� |
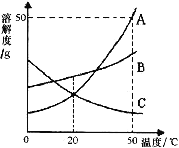
�ڼס�������ͬѧ���о�̼���ƺͳ���ʯ��ˮ�ķ�Ӧʱ�����������⣬ʵ�������������ͼB��ʾ��

ͼB
��������⡿����ʵ��δ�����ǵ�ԭ����ʲô?
����������衿
���룺�����ʯ��ˮ��Ũ�Ȼ�̼������Һ��Ũ���й�
����һ����ʹ�ø���Ũ�ȵ�ʯ��ˮ����Ѹ�ٲ������ǡ�
���������ʹ�ø���Ũ�ȵ�̼������Һ����Ѹ�ٲ������ǡ�
�����ۣ�����ʯ��ˮ��Ũ���Ѵ����ֵ�����£�����˼���һ_______�������������������
������ʵ�顿�ס�������ͬѧ�������ʵ����֤������Ƿ������
�ֱ���ʢ��2 mL����ͬŨ�ȵ�̼������Һ�μ�_____�α���ʯ��ˮ����¼�������£�
ʵ����� | 1 | 2 | 3 | 4 | 5 | 6 |
̼������Һ��Ũ�� | 0.5% | 0.8% | 1% | 5% | 8% | 10%�����ͣ� |
ʵ������ | ���� | ���� | ���� | ������ | ������ | ������ |
����������ۡ�
���ϱ���Ϣ��֪��������Ƿ������________����ǡ�����
��ʵ�鷴˼��
����ͬѧ�ظ�������ͼB������ͬѧ��ʵ�飬�۲쵽��ҺѸ�ٻ��ǡ�����ͬѧ������ͬѧʵ������IJ�֮ͬ����_______��
���𰸡� �� Ca(OH)2+Na2CO3��CaCO3 ��+2NaOH ��ɫҺ������ɫ��Һ��ð���ݣ��ձ��ڵij���ʯ��ˮ����� ������ 5 �� �μ���Һ���Ⱥ�˳��ʽ�������ȣ�
���������٢�.̼������Һ�Լ��ԣ���ʹ��̪��Һ��졣��.Na2CO3 + Ca(OH)2 = CaCO3�� + 2NaOH��������ɫ��������. Na2CO3+H2SO4= Na2SO4+CO2��+H2O ����������������ɵ���������Һ�����ԣ�����ʹ��̪��Һ��ɫ�����ɵĶ�����̼����ӵ����ܵ�����ʹ�ձ��еij���ʯ��ˮ����ǡ��ڡ���������衿������Һ�Ǹ��¶���������������������Һ���ʼ���һ��������������ʵ�顿���Ա�ʵ�������Ʊ���������������ۡ����ϱ���Ϣ��֪��������̼������ҺŨ��Խ�Ͳ�����������ʵ�鷴˼������ͬѧ������ͬѧʵ������IJ�֮ͬ���ǵμ���Һ���Ⱥ�˳��ͬ��

 ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д�
ѧ�ڸ�ϰһ��ͨѧϰ�ܶ�Ա��ĩ������ӱ����������ϵ�д� â���̸����������������ϵ�д�
â���̸����������������ϵ�д�