题目内容
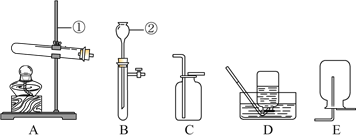
【题目】钢铁的冶炼是人类文明的一个重要标志,下图是模拟炼铁的实验装置图。
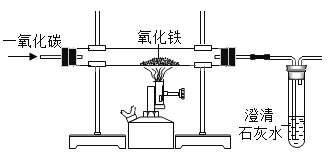
(1)请你写出冶炼生铁的化学方程式__________________。
(2)请写出一种证明产物中含铁粉的方法:__________________。
(3)此装置有不完善的地方,请写出其中一种改进的方法__________________。
(4)根据实验可知一氧化碳和二氧化碳的化学性质是不同的,请根据你的认识写出一点:___________。
【答案】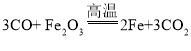 取少量产物于试管中,滴加适量稀盐酸,如有气泡产生证明含铁粉 用燃着的酒精灯除去有毒的尾气(或用气球收集) 一氧化碳有还原性,二氧化碳没有还原性(答案合理即可)
取少量产物于试管中,滴加适量稀盐酸,如有气泡产生证明含铁粉 用燃着的酒精灯除去有毒的尾气(或用气球收集) 一氧化碳有还原性,二氧化碳没有还原性(答案合理即可)
【解析】
(1)冶炼生铁的原理是一氧化碳和氧化铁在高温条件下生成铁和二氧化碳,化学方程式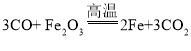 ;
;
(2)铁是活泼金属,能与酸反应生成氢气,证明产物中含铁粉的方法: 取少量产物于试管中,滴加适量稀盐酸,如有气泡产生证明含铁粉;
(3)一氧化碳通过灼热的氧化铁后,出来的气体,既有剩余的一氧化碳,也有反应生成的二氧化碳,如果直接排放到空气中,会造成空气污染,所以要有尾气处理装置,可以用燃着的酒精灯除去,或用气球收集起来;
(4)根据实验可知一氧化碳和二氧化碳的化学性质是不同的,如: 一氧化碳有还原性,二氧化碳没有还原性;一氧化碳有可燃性,二氧化碳没有;一氧化碳不能与碱的溶液反应,二氧化碳可以(答案合理即可)。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
【提出问题】![]() 白色沉淀A是什么?
白色沉淀A是什么?
(2)无色滤液B中的溶质有哪些?
【查阅资料】腌制皮蛋的原料配方是少量NaCl、CaO和过量![]() 的固体混合物。
的固体混合物。
【理论推理】![]() 白色沉淀A是
白色沉淀A是![]() ,请写出生成该沉淀的化学方程式______。
,请写出生成该沉淀的化学方程式______。
![]() 滤液B中含有
滤液B中含有![]() 、NaOH、NaCl三种溶质。
、NaOH、NaCl三种溶质。
【实验验证】为证明滤液B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
I | 取少量滤液B于试管中,加入过量的 | ______ | 滤液B中含有 |
II | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | ______ | |
III | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入 ______ 溶液 | 产生白色沉淀 |
【拓展提升】
![]() 向步骤I中加入过量
向步骤I中加入过量![]() 溶液的目的是______。
溶液的目的是______。
![]() 小妮同学认为若将步骤I中的
小妮同学认为若将步骤I中的![]() 溶液换为
溶液换为![]() 溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______
溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理______![]() 填“合理”或“不合理”
填“合理”或“不合理”![]() 。
。
![]() 小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的
小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的![]() 溶液,也能得出滤液B的溶质中含有
溶液,也能得出滤液B的溶质中含有![]() 和NaOH的结论,你是否同意他的观点并说明理由______。
和NaOH的结论,你是否同意他的观点并说明理由______。
【题目】根据表中数据,回答问题
温度/℃ 溶解度g/100g水 物质 | 0 | 20 | 40 | 60 |
KNO3 | 13.3 | 32.0 | 63.9 | 110 |
NaC1 | 35.7 | 36.6 | 37.3 | 38.4 |
10℃时,将固体KNO3、NaCl各20g分别放到盛有100g水的①、②两个烧杯中,充分溶解后,恢复到10℃,现象如图,请结合图示回答下列问题:
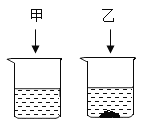
(1)能说明固体甲是NaCl的证据是_____。
(2)下列关于10℃时,甲、乙所得溶液的说法正确的是_____(填编号)。
A 溶液中溶质质量:烧杯①>烧杯②
B 烧杯②中溶液是饱和溶液,无法确定烧杯①中溶液是饱和溶液还是不饱和溶液。
C 将两个烧杯中溶液升温至20℃时,溶质质量分数烧杯①=烧杯②
D 若将烧杯①和烧杯②中物质全部混合,温度保持10℃,则仍有固体未全部溶解。
(3)40℃时,100克水中溶解了40克KNO3,恒温蒸发掉_____克水时(结果精确到0.1),开始析出晶体。
(4)当KNO3中混有少量NaCl时,提纯KNO3采用的方法是_____(填“蒸发结晶”或“降温结晶”)。
(5)现将经提纯的KNO3用于配制一定溶质质量分数的溶液,实验中用到的仪器除了电子天平、药匙、烧杯、玻璃棒、试剂瓶、标签外,还需用到的仪器有_____。
【题目】下列归纳总结完全正确的一组是( )
A.分子的特征 | B.数字“2”的含义 |
①水分子很小 ②固体物质的分子不运动 ③气体分子间的间隔很大 | ①Fe2+:1个亚铁离子带2个单位正电荷 ② ③NO2:1个二氧化氮分子中含有2个原子 |
C. 生活经验 | D.节约资源 |
①常用钢刷擦洗铝制品 ②食品包装中抽真空防腐 ③用汽油洗去衣服上的油污 | ①提倡使用太阳能 ②回收利用废旧金属 ③农业灌溉采用滴灌 |
A.AB.BC.CD.D