��Ŀ����
����Ŀ����������ԭ����ͭ�ķ����ⶨij����ͭ��Ʒ�Ĵ��ȣ����ʲ���������Ӧ����ͬѧ�����������ʵ��װ�ã�ȷ��ȡ15��0�˸�����Ʒ����ʵ�飺

��1��д��������ԭ����ͭ�Ļ�ѧ����ʽ
��2����ʵ���У���װ�õ������� ��
��3��ȷ��ȡ��ȫ��Ӧǰ��װ�ñ��Ͷ���������������

ijѧ������װ�ñ��������仯���м��㣬�õ�����ͭ��Ʒ�Ĵ���Ϊ ��ijѧ���Ҹ��ݶ��������仯ͬ�����Լ��㣬�õ�����ͭ��Ʒ�Ĵ��ȱȼĽ�� �������С������ȡ�����
��4���Ƚ����ּ��������е�ͬѧ��Ϊѧ������Ϻ���ȷ���е�ͬѧ��Ϊѧ���ҽ���Ϻ���ȷ�������۷���������ɹ�ʶ��ѧ���ҽ�����ڲ�����֮����ԭ���� ��
ѧ�����ֻ�дﵽ�����������㹻ȷ��װ���������� ��װ�ñ������� ��������Щ�������ȥ�ƾ��ƣ�Ҫ����ͨ��������ֱ�������Թ���ȴ��
���𰸡���1��H2+CuO ��Cu + H2O ��2�������װ���Ƿ����������ˮ������3��76��7%�����ڡ�
��4��װ�ö������տ����е�ˮ��������ɽ��ƫ�ߡ�װ�����й��屣�ְ�ɫ�����й����ɺ�ɫ��ȫ���ɫ��
��������
�������������̼���е�������֪��1����Ӧ�Ļ�ѧ����ʽΪH2+CuO ��Cu + H2O����2����ʵ���У���װ�õ������������װ���Ƿ����������ˮ��������3������װ�ñ��ļ�С��������Ϊ����ͭ����Ԫ�ص���������������ͭ����Ԫ�ص�����Ϊ��48��8g-46��5g=2��3g; ������ͭ������ΪY
H2+CuO![]() Cu + H2O
Cu + H2O
80 16
Y 2��3g
80/y=16/2��3g
Y=11��5g
����ͭ��Ʒ�Ĵ���Ϊ��11��5g/15g��100%=76��7%��
����Ũ�����������������������ɵ�ˮ����������������ˮ������Ϊ��
163��9g��161��2g=2��7g��
��Ҫ����2��7gˮ��Ҫ�μӷ�Ӧ������ͭ������ΪX��
H2+CuO![]() Cu+H2O
Cu+H2O
80 8
X 2��7g
���ݣ�80/8=X/2��7g���X=12g��
��������ͭ������������12g/15g��100%=80%
��4���Ƚ����ּ��������е�ͬѧ��Ϊѧ������Ϻ���ȷ���е�ͬѧ��Ϊѧ���ҽ���Ϻ���ȷ�������۷���������ɹ�ʶ��ѧ���ҽ�����ڲ�����֮����ԭ����װ�ö������տ����е�ˮ��������ɽ��ƫ�ߡ�װ����������װ�����й��屣�ְ�ɫ�����й����ɺ�ɫ��ȫ���ɫ��

 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�����Ŀ�������йػ�ѧ�仯����ȷ������
A��һ���г�������
B��һ��������������
C��һ���з��Ⱥͷ���
D��һ�����������ɻ���ɫ�ı�
����Ŀ����Ԫ���������ϵ���С�
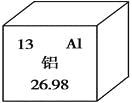
��1�����ǵؿ��к�����ߵ�________Ԫ�ء�
��2��Ԫ�����ڱ�����Ԫ�ص���Ϣ��ͼ��ʾ����ԭ�ӵĺ��������Ϊ________��
��3����Ԫ������Ȼ������Ҫ��Al2O3���ڣ�Al2O3����________(����ĸ���)��
A������ | B�������� | C���� | D���� |
��4����ҵ�õ������Al2O3�ķ���ұ��������ѧ����ʽΪ2Al2O3![]() 4Al��3O2�����÷�Ӧ���ڻ�����Ӧ�����е�____��Ӧ����Al2O3�����Ļ��ϼ�Ϊ ��
4Al��3O2�����÷�Ӧ���ڻ�����Ӧ�����е�____��Ӧ����Al2O3�����Ļ��ϼ�Ϊ ��
��5�������Ƴ���������Ҫ����������չ�Ժ�____�ԡ�