题目内容
【题目】已知氧化铜是一种黑色固体,可溶于稀硫酸。
【提出问题】是稀硫酸中的哪种粒子使氧化铜溶解了呢?
【猜想与假设】(1)可能是稀硫酸中的H2O分子使氧化铜溶解了;
(2)_______________________________________________ ;
(3)________________________________________________ 。
【设计实验方案】某同学设计了如图三组实验:
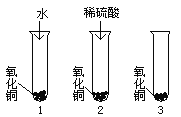
【进行实验】实验1中氧化铜不溶解;实验2中氧化铜溶解;实验3中可加入的试剂是_________ 。目的是 _______ 。
【获得结论】 ___________________________________________________________。
【交流反思】(1)写出实验2中所发生反应的化学方程式_____________________________ 。
(2)你认为实验室中也可用 ________溶解氧化铜。
【答案】 可能是稀硫酸中的H+离子使氧化铜溶解了 可能是稀硫酸中的SO42-离子使氧化铜溶解了 硫酸钠溶液 检验SO42-离子是否能溶解氧化铜 是稀硫酸中的H+离子使氧化铜溶解了 CuO+H2SO4 == CuSO4 +H2O 盐酸
【解析】【猜想与假设】根据所学知识,稀硫酸中存在![]() 、
、![]() 、
、![]() 三种粒子,三种粒子中的某一种使
三种粒子,三种粒子中的某一种使![]() 溶解,假设1可能是稀硫酸中的
溶解,假设1可能是稀硫酸中的![]() 使
使![]() 溶解,假设2可能是稀硫酸中的
溶解,假设2可能是稀硫酸中的![]() 使
使![]() 溶解,假设3可能是稀硫酸中的
溶解,假设3可能是稀硫酸中的![]() 使
使![]() 溶解;【进行实验】(1)实验Ⅰ中,无明显现象,说明水分子不能使氧化铜溶解,可以验证假设1不成立;因为Ⅰ实验证明了
溶解;【进行实验】(1)实验Ⅰ中,无明显现象,说明水分子不能使氧化铜溶解,可以验证假设1不成立;因为Ⅰ实验证明了![]() 不能使
不能使![]() 溶解的结论,实验Ⅱ中既有
溶解的结论,实验Ⅱ中既有![]() 、又有
、又有![]() 和
和![]() ,其中水分子已经证明了不能使
,其中水分子已经证明了不能使![]() 溶解,而且知道实验Ⅱ中的现象是氧化铜溶解,但三个实验必须得出实验结果,所以实验Ⅲ中应加入的物质应该是含硫酸根的溶液,进而排除硫酸根是否能溶解氧化铜的结论,所以在Ⅲ中可以加入硫酸钠溶液,目的是检验
溶解,而且知道实验Ⅱ中的现象是氧化铜溶解,但三个实验必须得出实验结果,所以实验Ⅲ中应加入的物质应该是含硫酸根的溶液,进而排除硫酸根是否能溶解氧化铜的结论,所以在Ⅲ中可以加入硫酸钠溶液,目的是检验![]() 离子是否能溶解氧化铜;【获得结论】由实验可知,实验Ⅰ水不能溶解氧化铜;实验Ⅲ氧化铜也不能溶解于硫酸钠(带有硫酸根的盐)溶液;实验Ⅱ氧化铜能溶解于酸溶液,可得出是稀硫酸中的
离子是否能溶解氧化铜;【获得结论】由实验可知,实验Ⅰ水不能溶解氧化铜;实验Ⅲ氧化铜也不能溶解于硫酸钠(带有硫酸根的盐)溶液;实验Ⅱ氧化铜能溶解于酸溶液,可得出是稀硫酸中的![]() 离子使氧化铜溶解了的结论;实验2中所发生反应的化学方程式:
离子使氧化铜溶解了的结论;实验2中所发生反应的化学方程式: ![]() ,故实验室中也可用盐酸溶解氧化铜。
,故实验室中也可用盐酸溶解氧化铜。

 阅读快车系列答案
阅读快车系列答案【题目】根据如图回答问题:
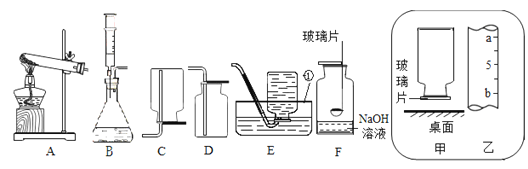
(1)写出图中标号仪器名称:①______________ 。
(2)实验室用高锰酸钾制取氧气应选用的装置组合为________(填字母,从装置A--E中选择),还缺少一种实验用品__________,其作用为__________________________。写出高锰酸钾制氧气的化学方程式_______________________________。
(3)某兴趣小组在实验室用B装置来制取氧气,发生反应的化学方程式为____________,反应后要回收二氧化锰固体,应对反应后的混合物进行的实验操作是________、洗净、干燥。
(4)用F装置做硫在氧气中的燃烧实验,燃烧结束后取出燃烧匙,立即用玻璃片盖住瓶口并振荡,若将集气瓶倒转,发现玻璃片被“吸住”而不掉下来(如图甲),则F装置中NaOH溶液的作用是________________________________。为了完成上述实验,用l0mL量筒量取6mL的NaOH溶液,读数时量筒内液体的凹液面最低处应与乙图中_______处(填“a”或“b”)刻度线保持水平。
(5)我们知道氧气能使带火星的木条复燃,那么使带火星的木条复燃是否一定需要纯氧呢?为了弄清这个问题,某化学探究小组进行了如下探究:
Ⅰ.取5个大小相同的集气瓶,分别编号1、2、3、4、5,并分别使瓶内留有占集气瓶10%、20%、30%、40%、50%的水(余下的为空气),用玻璃片盖住,并倒扣于装有水的水槽中。
Ⅱ.分别用排水法向上述5个瓶中通入氧气,小心把5个瓶内的水排完用玻璃片盖住瓶口,取出正立放好。
Ⅲ.分别将带火星的木条伸入5个瓶中,现象如下:
编号 | 1 | 2 | 3 | 4 | 5 |
现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
根据实验回答下列问题:
①从观察到的现象可知,使带火星的木条复燃所需氧气的最小体积介于______ 号瓶和______号瓶之间。
②用排水法收集氧气后,4号瓶中氧气的体积分数约为________。