题目内容
【题目】(8分)根据下列实验回答问题。
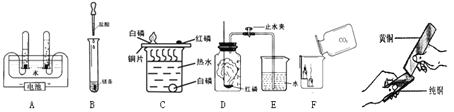
(1)A实验说明水是由 组成的。
(2)B实验中的主要现象是 。
(3)C实验说明白磷燃烧需要 和 条件。
(4)D中发生反应的化学方程式为 ,
(5)E实验说明CO2具有 和 性质。
(6)F实验可说明 。
【答案】(1)氢元素和氧元素;(2)剧烈反应,并有大量气泡生成;
(3)与氧气接触,温度达到白磷的着火点;(4)4P + 5O2 ![]() 2P2O5 (5)密度比空气大,不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大;
2P2O5 (5)密度比空气大,不燃烧也不支持燃烧;(6)黄铜比纯铜的硬度大;
【解析】
试题分析:(1)A是电解水实验,电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,质量比为8:1 ,该实验能得出水是由氢元素和氧元素组成的结论;(2)实验B是镁与盐酸反应的实验,该实验中镁与盐酸会剧烈反应,并产生大量的气泡;(3)C实验是探究燃烧的条件。该实验中铜片上的白磷能燃烧,但铜片上的红磷和水中的白磷不能燃烧,故得出可燃物燃烧的条件是与氧气接触,温度达到白磷的着火点;(4)实验D是测定空气成分实验,该实验中红磷燃烧产生大量的白烟:4P + 5O2 ![]() 2P2O5;(5)E是倾倒二氧化碳实验,该实验中能观察到蜡烛由下而上依次熄灭,该实验说明二氧化碳的密度比空气大,不燃烧也不支持燃烧;(6)F实验是比较纯金属和合金硬度的大小,合金的硬度比纯金属的硬度大,即黄铜比纯铜的硬度大。
2P2O5;(5)E是倾倒二氧化碳实验,该实验中能观察到蜡烛由下而上依次熄灭,该实验说明二氧化碳的密度比空气大,不燃烧也不支持燃烧;(6)F实验是比较纯金属和合金硬度的大小,合金的硬度比纯金属的硬度大,即黄铜比纯铜的硬度大。

练习册系列答案
相关题目