题目内容
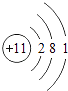
【题目】在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.请回答下列问题: 
(1)产生氢气g,刚开始滴加稀硫酸没有氢气放出的原因是 .
(2)所滴加的稀硫酸中溶质的质量分数.
(3)铝箔中铝元素的质量.
【答案】
(1)0.2;稀硫酸先和氧化铝反应
(2)解:设和稀硫酸反应的铝的质量为x,和铝反应的稀硫酸中硫酸质量为y,
2Al+3H2SO4═Al2(SO4)3+3H2↑,
54 294 6
x y 0.2g
![]() =
= ![]() =
= ![]() ,
,
x=1.8g,y=9.8g,
所滴加的稀硫酸中溶质的质量分数为: ![]() ×100%=10%,
×100%=10%,
答:所滴加的稀硫酸中溶质的质量分数为10%
(3)解:铝箔中铝元素的质量为:1.8g+(2.14g﹣1.8g)× ![]() ×100%=1.98g,
×100%=1.98g,
答:铝箔中铝元素的质量为1.98g
【解析】解:(1)由图中可知,产生氢气的质量是0.2g;
刚开始滴加稀硫酸没有氢气放出的原因是稀硫酸先和氧化铝反应.
故填:0.2;稀硫酸先和氧化铝反应.
铝能和空气中的氧气反应生成氧化铝,氧化铝和稀硫酸反应生成硫酸铝和水,铝能和稀硫酸反应生成硫酸铝和氢气,根据反应的化学方程式和提供的数据可以进行相关方面的计算和判断.

 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】实验小组在研究酸和碱的化学性质时,对稀硫酸与NaOH溶液的反应展开探究,请完成他们的探究记录. 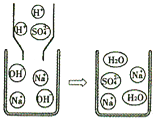
【提出问题】稀硫酸与NaOH溶液混合后是否发生了化学反应?
(1)【查阅资料】①稀硫酸与NaOH溶液混合后,虽然没有明显现象,但确实发生了化学反应,如图是反应的微观示意图,从该图可以看出,稀硫酸与NaOH溶液反应的本质是;
②NaOH溶液能与硫酸铜溶液反应,化学反应方程式为:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4;
(2)【实验器材】NaOH溶液、稀硫酸、酚酞试液、pH试纸、烧杯、玻璃棒、胶头滴管、试管、镊子、玻璃片等.
【实验探究】实验小组设计了三个方案进行实验.
实验操作 | 实验现象或数据 | 实验结论 | |
方案1 | 取少量NaOH溶液于试管中,测定其pH,将一定量的稀硫酸倾倒入该溶液中,混合均匀后测定其pH | NaOH溶液的pH>7,混合均匀后溶液的pH<7 | 稀硫酸与NaOH溶液混合后发生了化学反应, |
方案2 | 取少量NaOH溶液倒入烧杯中,滴入几滴酚酞试液,再用滴管逐滴滴入稀硫酸,并用玻璃棒不断搅拌 | ||
方案3 | 取少量稀硫酸于试管中,倒入少量硫酸铜溶液,再用滴管逐滴滴入NaOH溶液,边滴边振荡 |
(3)【反思交流】①实验过程中需要多次测定溶液的pH,所以每使用玻璃棒蘸取溶液前,必须进行的预处理;
②由方案2和方案3可知,对于许多没有明显现象的化学反应,可通过的方法以证明反应确实发生了.