题目内容
用离子符号、化学式或化学方程式按下列要求填空:
(1)硫酸钠中的阴离子 ; (2)氯化亚铁中的阳离子 ;
(3)用于造纸、洗涤剂的盐 ;(4)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理 .
(1)硫酸钠中的阴离子
(3)用于造纸、洗涤剂的盐
考点:化学符号及其周围数字的意义,书写化学方程式、文字表达式、电离方程式
专题:化学用语和质量守恒定律
分析:(1)硫酸钠中的阴离子是硫酸根离子.
(2)氯化亚铁中的阳离子是亚铁离子.
(3)碳酸钠是用于造纸、洗涤剂的盐.
(4)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可.
(2)氯化亚铁中的阳离子是亚铁离子.
(3)碳酸钠是用于造纸、洗涤剂的盐.
(4)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,写出反应的化学方程式即可.
解答:解:(1)硫酸钠中的阴离子是硫酸根离子,其离子符号为:SO42-.
(2)氯化亚铁中的阳离子是亚铁离子,其离子符号为:Fe2+.
(3)碳酸钠是用于造纸、洗涤剂的盐,其化学式为:Na2CO3.
(4)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3
2Fe+3CO2.
故答案为:(1)SO42-;(2)Fe2+;(3)Na2CO3;(4)3CO+Fe2O3
2Fe+3CO2.
(2)氯化亚铁中的阳离子是亚铁离子,其离子符号为:Fe2+.
(3)碳酸钠是用于造纸、洗涤剂的盐,其化学式为:Na2CO3.
(4)高炉炼铁(以赤铁矿为例)过程中还原成铁的主要反应原理,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为3CO+Fe2O3
| ||
故答案为:(1)SO42-;(2)Fe2+;(3)Na2CO3;(4)3CO+Fe2O3
| ||
点评:本题难度不大,主要考查同学们对常见化学用语(化学式、化学方程式、离子符号等)的书写和理解能力.

练习册系列答案
相关题目
纳米碳管是一种由碳原子构成的直径为几个纳米的空心管.下列有关纳米碳管的说法错误的是( )
| A、纳米碳管是一种新型的化合物 |
| B、纳米碳管在常温下化学性质稳定 |
| C、纳米碳管管道多,吸附能力强 |
| D、纳米碳管完全燃烧后生成物是二氧化碳 |
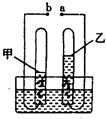 如图是通电分解水的简易装置图,回答下列问题.
如图是通电分解水的简易装置图,回答下列问题.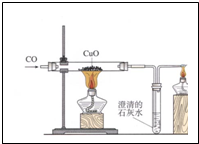 某兴趣小组利用如图装置进行试验,请回答相关的问题:
某兴趣小组利用如图装置进行试验,请回答相关的问题: 程伟同学将浑浊的湖水样品,倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用下列装置进行过滤,回答下列问题:
程伟同学将浑浊的湖水样品,倒人烧杯中,先加入明矾粉末搅拌溶解,静置一会儿后,采用下列装置进行过滤,回答下列问题: